
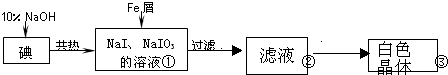
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
分析 由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)碘元素位于元素周期表中的第五周期第ⅦA族;
(2)反应①为碘单质和氢氧化钠的反应,化合价升高和降低的元素均是I元素,化合价由0价分别变化为+5价、-1价,根据得失电子守恒和原子守恒书写方程式;
(3)判断反应①中碘是否反应完全,本质为检验碘单质的存在,碘与淀粉作用显示蓝色,碘在四氯化碳中易溶,在四氯化碳中显示紫红色,据此分析解答;
(4)考虑空气中氧气的氧化作用;
(5)NaIO3的检验可以根据碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成碘单质,然后通过淀粉来检验碘单质的存在,从而确定碘酸钠的存在;NaOH溶液的存在可以向溶液中滴加几滴酚酞溶液,如果溶液显红色,说明氢氧化钠的存在;粗晶体经过重结晶可得到纯度更高的晶体.
解答 解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI;
(1)碘元素位于元素周期表中的第五周期第ⅦA族;
故答案为:五;ⅦA;
(2)反应①为碘单质和氢氧化钠的反应,化合价升高和降低的元素均是I元素,化合价升高的I元素对应的产物NaIO3,化合价降低的I元素对应的产物为NaI,根据得失电子守恒,氧化剂和还原剂的物质的量之比是5:1,所以在反应的3molI2中,有$\frac{1}{3}$mol的I2做还原剂,有$\frac{5}{3}$mol的I2做氧化剂,反应的方程式为:3I2+6NaOH═5NaI+NaIO3+3H2O;
故答案为:3I2+6NaOH═5NaI+NaIO3+3H2O;
(3 )淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全);
故答案为:取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)低温下分离出NaI样品的过程中,要防止NaI被空气中的氧气氧化,要隔绝空气;
故答案为:隔绝空气;
(5)NaIO3的检验可以根据碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成碘单质,然后通过淀粉来检验碘单质的存在,从而确定碘酸钠的存在;NaOH溶液的存在可以向溶液中滴加几滴酚酞溶液,如果溶液显红色,说明氢氧化钠的存在,具体操作如下,首先将白色晶体溶于水,并滴2滴淀粉溶液,得到无色溶液,然后用两支试管分别取两溶液少许,在第一支试管中滴加硫酸,如果存在碘酸钠,酸性条件下发生反应IO3-+5I-+6H+=3I2+3H2O,遇淀粉变蓝色,在另一支试管中滴入无色的酚酞,如果溶液变红,说明氢氧化钠的存在;粗晶体经过重结晶可得到纯度更高的晶体.
故答案为:加入足量的1 mol/LH2SO4,滴入几滴酚酞溶液,溶液变红,重结晶.
点评 本题考查物质制备实验,明确制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及碘的特性,有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 将水加热,Kw增大,pH增大,仍呈中性 | |
| C. | 向0.1mol/L醋酸溶液中加水,溶液中水电离产生的c(H+)将减小 | |
| D. | 向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金中铁、锌的物质的量之和为0.02mol | |
| B. | 合金中铜的质量无法确定 | |
| C. | 合金中铁、铜的物质的量之和为0.01mol | |
| D. | 1.30g>铁和锌质量之和>1.12g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 维生素C具有还原性,在人体内起抗氧化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示.
如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
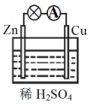
| A. | Zn为负极,Cu为正极 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 正极反应式为Cu-2e-Cu2+ | D. | 原电池的反应本质是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com