
分析 食物的酸碱性与化学上所指的溶液的酸碱性是不同的概念,它是按食物在体内代谢最终产物的性质来分类的,蛋白质是常见的酸性食物,蛋白质在体内经过消化、吸收后,最后氧化成酸,是常见的酸性食物,蔬菜、水果含钾、钠、钙、镁等盐类,在人体内代谢后生成碱性物质,使体液呈弱碱性.
解答 解:酸性食物和碱性食物是根据食物在人体内消化后终端产物的酸碱性来划分的,而不是食物本身的酸碱性,通常,富含S、Cl、P、N等非金属元素的食物进入体内,通过转化后会产生酸性物质,而富含K、Ca、Na、Fe、Zn、Mg等金属元素的食物进入体内,通过转化后产生碱性物质.鸡蛋、猪瘦肉在体内经过消化、吸收后,最后氧化成酸,是常见的酸性食物,所以动物性食物多半是酸性食物,植物性食物中,除五谷、杂粮、豆类外,多半为碱性物质,
故答案为:酸性物质;碱性物质.
点评 本题考查了食物的酸碱性判断,注意食物的酸碱性是根据食物在体内代谢最终产物的性质来分类,题目难度不大.


科目:高中化学 来源: 题型:推断题
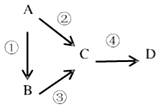 A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.
A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化关系,其中A是单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用澄清石灰水溶液鉴别苏打、小苏打 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
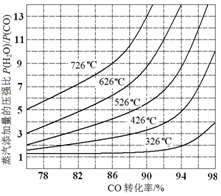 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO3-、CO32- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| B. | 氢能是一种新型能源,具有热值高、资源丰富、无毒、无污染的优点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 合成氨工业中,使用催化剂不能提高H2和N2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
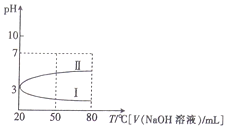
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com