
 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.分析 (1)CH3COOH溶液的pH=3,该溶液中c(CH3COO-)≈c(H+)=0.001mol/L,c(CH3COOH)≈0.1mol/L,电离度=$\frac{电离的醋酸浓度}{醋酸初始浓度}×100%$;由水电离的c(H+)=c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;
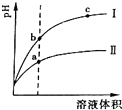
(2)醋酸是弱电解质、HCl是强电解质,pH相同的醋酸和盐酸,醋酸浓度较大,加水稀释促进醋酸电离,稀释相同的倍数,醋酸中氢离子浓度较大,所以稀释相同倍数后醋酸pH变化较小;溶液导电能力与离子浓度成正比;
(3)等物质的量的醋酸和NaOH恰好完全反应生成醋酸钠,醋酸根离子水解导致溶液呈碱性;结合电荷守恒物料守恒判断离子浓度关系;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,再结合离子水解、电荷守恒判断.
解答 解:(1)CH3COOH溶液的pH=3,该溶液中c(CH3COO-)≈c(H+)=0.001mol/L,c(CH3COOH)≈0.1mol/L,电离度=$\frac{电离的醋酸浓度}{醋酸初始浓度}×100%$=$\frac{0.001mol/L}{0.1mol/L}×100%$=1%;由水电离的c(H+)=c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.001}$mol/L=1×10-11mol.L-1,
故答案为:1%;1×10-11mol.L-1;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:?;a;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为NH4++H2O?NH3•H2O+H+,
A.氯化铵能水解但水解程度较小,所以c(H+)<c(NH4+),故错误;
B.铵根离子水解而使溶液呈酸性,所以c(OH-)<c(H+),故错误;
C.溶液中存在物料守恒,根据物料守恒得c(NH4+)+c(NH3•H2O)=0.05mol•L-1,故错误;
D.根据质子守恒得c(H+)=c(NH3•H2O)+c(OH-),故正确;
故答案为:NH4++H2O?NH3•H2O+H+;D;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,钠离子不水解、铵根离子水解,溶液中存在电荷守恒c(Na+)+c(NH4+)=2c(SO42-),所以离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
点评 本题考查弱电解质的电离和酸碱混合溶液定性判断,为高频考点,由弱电解质电离特点结合电荷守恒、物料守恒来分析解答,难点是(4)题,明确溶液中的溶质及其性质,易错点是(3)题C选项,二者混合溶液体积增大一倍,导致浓度降为原来的一半.


科目:高中化学 来源: 题型:选择题
| A. | 人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(0H)3和O2可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-=CO2↑+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
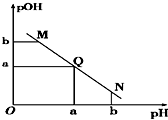 某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg c[OH-])与pH的变化关系如图所示,则( )| A. | M点所示溶液导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度不相同 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的正盐化学式为BmAn | |
| B. | 该盐中存在着一定水解的离子,该离子水解方程式为:Bm++mH2O?B(OH)m+mH+ | |
| C. | 生成的盐为强酸弱碱盐 | |
| D. | HnA为弱酸,其第一步电离方程式为:HmA?Hm-1A-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 用NaOH标准溶液滴定醋酸溶液至中性时,醋酸则被完全中和 | |
| C. | 将Na2S2O3溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCH2Br | D. | BrCH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com