
| ①5种阳离子为:Mg2+、Ba2+、Fe3+、X、Y |
| ②5种阴离子为:OH-、Cl-、CO32-、NO3-、Z |
| ③X是短周期主族元素中金属性最强的元素形成的简单阳离子;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的. |
 ,铝离子的电子式即为离子符号;
,铝离子的电子式即为离子符号; ,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为:
,Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的,即为Al3+,电子式为Al3+,故答案为: ;Al3+;
;Al3+;

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
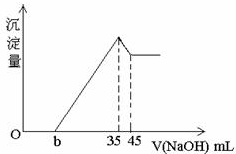 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量 | B、电子总数 |
| C、原子总数 | D、密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体甲可能为CO2 或者SO2 |
| B、沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C、该溶液中肯定存在的离子有K+、AlO2-、SO32-、SO42-、NO2- |
| D、只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com