
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
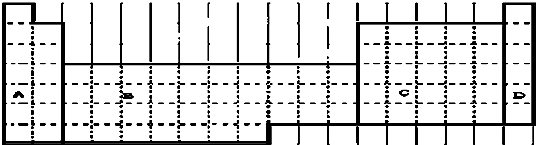
查看答案和解析>>
科目:高中化学 来源: 题型:
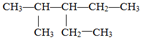 的名称是
的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:
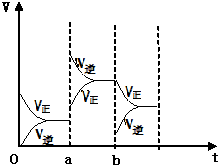 (1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.
(1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量盐酸 |
| 足量盐酸 |
| 足量盐酸 |
| 过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.
用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①③④ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com