
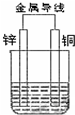
分析 Ⅰ.(1)当电解质溶液为H2SO4溶液时,锌是负极,铜极上是氢离子得到电子;
(2)当电解质溶液为CuSO4溶液时,锌是负极,铜极上是铜离子得到电子生成单质铜;
(3)当电解质溶液为稀食盐水时,发生吸氧腐蚀,铜是正极发生还原反应;
Ⅱ.正极是氧气发生还原反应,而电解溶液是酸与氢离子结合成水,负极是氢气发生氧化反应.
解答 解:Ⅰ(1)当电解质溶液为H2SO4溶液时,锌是负极,铜极上是氢离子得到电子,所以Cu片的电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)当电解质溶液为CuSO4溶液时,锌是负极,铜极上是铜离子得到电子生成单质铜,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)当电解质溶液为稀食盐水时,发生吸氧腐蚀,铜是正极发生还原反应,氧气得电子,生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
Ⅱ.负极是氢气发生氧化反应,电极反应式为:2H2-4e-=4H+;正极是氧气发生还原反应,而电解溶液是酸与氢离子结合成水,电极反应式为O2+4H++4e-=2H2O,
故答案为:2H2-4e-=4H+;O2+4H++4e-=2H2O.
点评 本题考查了原电池原理,明确各个电极上得失电子及发生的反应即可解答,难点是电极反应式的书写,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
 σ
σ查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{136}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{136}$I位于元素周期表中第四周期ⅦA族 | |
| C. | ${\;}_{53}^{136}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{136}$I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com