

| ||
| ||
| 1 |
| 2 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� |
| 0.1mol?L-1��ˮ | pH=11��ˮ | 0.1mol?L-1���� | pH=3���� |
| A����ϡ�͵�ԭ����100����pH�����ͬ | ||
| B��������٢ۻ�ϡ�������ڢܻ�����õ���Һ�������� | ||
C���٢��зֱ��������CH3COONa���壬
| ||
| D����20mL�Ģ���Һ��10mL�Ģ���Һ��Ϻ�����Һ�ʼ��ԣ���c��NH4+����c��Cl-����c��NH3?H2O����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| Na | Mg | Si | |
| I1/kJ?mol-1 | 496 | 738 | 787 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
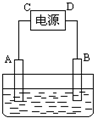 ��һ�����ξ��壬�仯ѧʽ��ʾΪM��NO3��x?nH2O���ⶨ��Ħ������Ϊ242g?mol-1��ȡ1.21g�þ�������ˮ���100mL��Һ��������Һ������ͼ��ʾװ���У���ʯī���缫���е�⣮����0.01mol����ͨ���缫ʱ����Һ�еĽ���������ȫ����������A���õ�����0.32g���ش�
��һ�����ξ��壬�仯ѧʽ��ʾΪM��NO3��x?nH2O���ⶨ��Ħ������Ϊ242g?mol-1��ȡ1.21g�þ�������ˮ���100mL��Һ��������Һ������ͼ��ʾװ���У���ʯī���缫���е�⣮����0.01mol����ͨ���缫ʱ����Һ�еĽ���������ȫ����������A���õ�����0.32g���ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH3COOH+OH-�TCH3COO-+H2O |
| B��H2O+H2O?H3O++OH- |
| C��NH4++H2O?NH3?H2O+H+ |
| D��PO43-+H2O?HPO42-+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��0.1mol�ǻ��� ���к��еĵ�����Ϊ0.7NA ���к��еĵ�����Ϊ0.7NA |
| B��1L 0.1mol?L-1��AlCl3��Һ�к���Al3+����ĿΪ0.1NA |
| C��0.1mol N2������H2��Ӧ��ת�Ƶĵ�����Ϊ0.6NA |
| D����״���£�1.12L HCHO��Cԭ�ӵ���ĿΪ0.05NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com