
分析 根据n=$\frac{m}{M}$进行计算求解;同时设生成氢气的体积在标准状况下是VL,
由Fe+H2SO4 =FeSO4+H2↑,
56g 22.4L
5.6g V,由此分析求解.
解答 解:n=$\frac{m}{M}$=$\frac{5.6g}{56g/mol}$=0.1mol;
设生成氢气的体积在标准状况下是VL,
由Fe+H2SO4 =FeSO4+H2↑,
56g 22.4L
5.6g V,所以$\frac{56}{5.6}=\frac{22.4}{V}$,则V=2.24L,
答:(1)参加反应的Fe的物质的量是0.1mol;
(2)生成氢气的体积在标准状况下是2.24L.
点评 本题考查了有关方程式的计算、氧化还原反应的应用,题目难度中等,侧重于考查学生的分析能力和计算能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
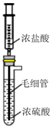 实验室用如图装置制备HCl气体.推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理分析不正确的是( )
实验室用如图装置制备HCl气体.推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理分析不正确的是( )| A. | 混合时放热使HCl溶解度减小 | |
| B. | 浓硫酸具有吸水性,吸收了盐酸中水分 | |
| C. | 浓盐酸具有挥发性,利于HCl气体逸出 | |
| D. | 浓盐酸中HCl以分子形式存在,利于HCl气体逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可刻蚀石英制艺术品 | |
| B. | 活性炭、SO2和Na2O2都具有漂白作用,且漂白的化学原理相同 | |
| C. | 石油的裂化、煤的气化、Na2FeO4杀菌消毒均属于化学变化 | |
| D. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
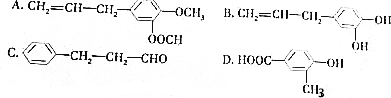
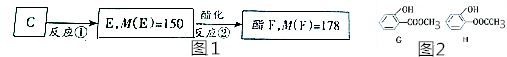
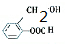 、
、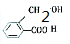 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
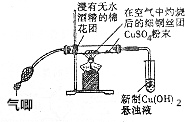 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
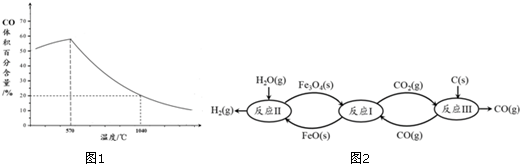

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com