
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。

请回答:
(1)装置 A 中发生的化学反应方程式为________________________。
(2)装置 D 中试管口放置的棉花中可以浸上NaOH溶液, 其作用是_____________。
(3)装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯。B 中应放置的液体是(填字母) ____。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
(4)实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。有一定量的余酸但未能使铜片完全溶解,你认为可能的原因是____________。
【答案】2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑ 吸收多余的二氧化硫,防止污染空气 c 反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应
CuSO4+2H2O+SO2↑ 吸收多余的二氧化硫,防止污染空气 c 反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应
【解析】
(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收;
(3)关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,导致水加入长颈漏斗中;B装置的作用起缓冲作用,所以B中液体不能吸收二氧化硫;
(4)加热条件下,浓硫酸和Cu反应而稀硫酸和Cu不反应。
(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)二氧化硫有毒不能直接排空,二氧化硫属于酸性氧化物,能被碱液吸收,则NaOH溶液的作用是吸收多余的二氧化硫,防止污染空气;
(3)B装置的作用起缓冲作用,所以B中液体不能吸收二氧化硫;
a.二氧化硫气体是酸性氧化物,易溶于水,故a错误;
b.酸性KMnO4溶液能和二氧化硫发生氧化还原反应而吸收二氧化硫,故b错误;
c.饱和NaHSO3溶液和二氧化硫不反应且抑制二氧化硫溶解,故c正确;
d.浓溴水能和二氧化硫发生氧化还原反应而吸收二氧化硫,故d错误;
故答案为c;
(4)有一定量的余酸但未能使铜片完全溶解,由此得出反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应。


科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )

A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成份如下图所示:
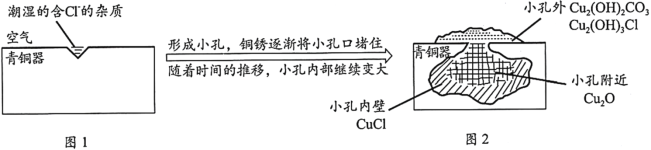
已知:2CuCl+H2O![]() Cu2O+2HCl
Cu2O+2HCl
下列分析不正确的是
A.氧气是正极反应物B.铜锈的成份与氧气浓度、pH有关
C.图2中,Cl-从小孔内向小孔外移动D.青铜中的锡也会发生电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
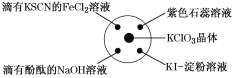
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)![]() xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
请计算:(写出计算过程,无过程不给分)
(1)平衡时A的浓度;______反应开始前容器中B的物质的量;_____
(2)前5 min内用B表示的平均反应速率;______
(3)化学反应方程式中x的值;_____
(4)5min时物质A的转化率。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
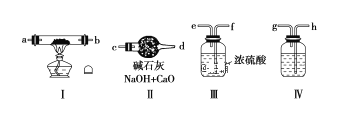
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:
空气→Ⅳ→____→___→____(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是____,其作用是_______。
(3)装置Ⅱ的作用是______。
(4)操作中通空气和加热的先后顺序为________。
(5)若去掉装置Ⅲ,装置Ⅰ中除反应生成Na2O2外,还可能发生的反应有______(写出两个化学方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com