
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO、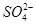 、
、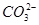 、
、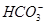 、
、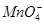 。
。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、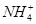 。
。
将该白色粉末进行下列实验,观察到的现象如下:
实验操作 | 现象 |
a.取少量粉末,加水、振荡 | 全部溶解、 |
溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
c.取少量粉末,加盐酸 | 无明显现象 |
d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有 (填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有 。
(3)从c实验中,可推断粉末中不可能有 。
(4)从d实验中,可推断粉末中不可能有 ,一定含有 。
(5)以上各实验仍无法确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0. 1 mol·L-1AgNO3溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:填空题
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 |
|
阳离子 | Al3+、Cu2+、Mg2+、 |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
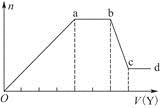
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
物质的量浓度相同的下列溶液中,含离子和分子种类最多的是
A.CaCl2 B.CH3COONa
C.氨水 D.K2S
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
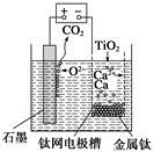
A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法中正确的是
A.84 g NaHCO3晶体中含有NA个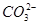
B.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2NA
C.标准状况下,11.2 L臭氧中含NA个氧原子
D.78 g Na2O2与足量的CO2反应,电子转移个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com