
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
(1)1.1×10-5 (2分)
(2)MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O(2分)
溶液由无色变为浅紫色(紫色、紫红色),且半分钟不褪色 (1分)
(3)n(SO42-)= n(BaSO4)=0. 466g/233g·mol-1=2. 00×10-3 mol (或2.00mmol) (2分)
n(Fe2+)=5×0. 02000 mol·L-1×10. 00 mL/1000 mL·L-1=1. 000×10-3mol (1分)
n(NH4+)=2×2. 00×10-3 mol-2×1. 000×10-3mol=2. 000×10-3mol (1分)
n(H2O)=(1.5680 g×25.00 mL/100.00mL-1.000×10-3mol
×152g·mol-1-1.000×10-3mol×132g·mol-1)/18 g·mol-1
=6. 000×10-3mol (2分)
x∶y∶z=n(FeSO4)∶n[ (NH4)2SO4]∶n(H2O)=1∶1∶6
该摩尔盐的化学式为FeSO4·(NH4)2SO4·6H2O (1分)
【解析】
试题分析:本题是测定物质组成的计算题。
(1)Ksp= c(Ba2+) × c(SO42-)=1.1×10-10 c(Ba2+)= 1.1×10-5 mol·L-1
(3)在步骤②中得到的白色固体为BaSO4,由此计算出SO42-的含量;在步骤③中根据反应方程式计算出溶液中含有的Fe2+的含量,再根据电荷守恒计算出溶液中含有NH4+的含量。但要注意所取的溶液只是原溶液的1/5,计算原溶液中SO42-和Fe2+的物质的量。最后根据总质量计算水的含量,确定组成。
考点:考查工业测定物质组成中的有关实验操作、计算等内容。


科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
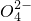 )≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥______mol?L-1.
)≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥______mol?L-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com