
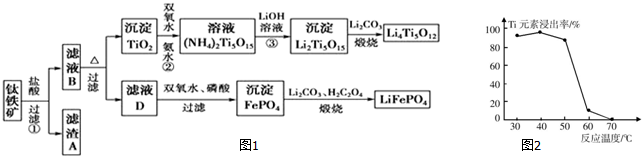
分析 铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B中含有MgCl2、CaCl2、FeCl2、TiCl2等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
(5)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁;
(6)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比.
解答 解:铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B中含有MgCl2、CaCl2、FeCl2、TiCl2等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,
故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,反应离子方程式为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+,
故答案为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+;
(6)根据电子守恒,过氧化氢氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,因此可得关系式:H2O2~H2C2O4,
设双氧水质量为x,草酸质量为y,则:
H2O2~H2C2O4
34 90
x×17% y
所以34y=90×x×17%,整理可得x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9.
点评 本题以钛铁矿制备锂离子电池电极材料工艺流程为载体,考查陌生方程式书写、元素化合物性质、对条件控制的分析评价、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:SiO2>NaCl>CH4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
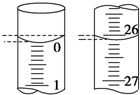 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
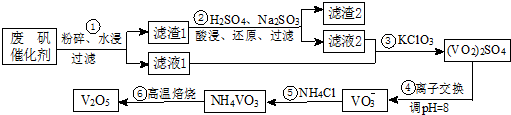
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
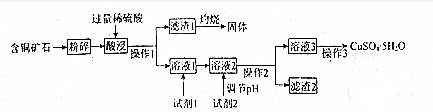
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com