
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.20 molCl2和0.20 molCO,反应达到平衡前的速率:υ(正)>υ(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和1.2molCO,达到平衡时,Cl2的转化率大于60% |
| 0.2×0.2 |
| 0.3 |
| ||||
|
| 1mol-0.4mol |
| 1mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
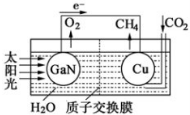
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、77.6 kJ |
| B、-77.6 kJ?mol-1 |
| C、+77.6kJ?mol-1 |
| D、-886.8kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2易吸收空气中的水分 |
| B、Ca(ClO)2易与盐酸反应 |
| C、Ca(ClO)2见光易分解 |
| D、Ca(ClO)2易与空气中的CO2和水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1>0,△H3<0 |
| B、△H2>0,△H4>0 |
| C、△H4=△H1+△H2-△H3 |
| D、△H3=2△H1+3△H2-△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com