
| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |
分析 A.化学变化是分子原子层次上的变化;
B.二氧化碳导致温室效应;
C.根据通过露天焚烧或深埋的方式进行处理垃圾,会污染大气、水体和土壤解答;
D.根据光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水.
解答 解:A.朝鲜第三次核试验产生的放射性物质的衰变为物理上的变化,故A错误;
B.二氧化碳导致温室效应,导致酸雨的主要气体为二氧化硫,故B错误;
C.对所有垃圾通过露天焚烧或深埋的方式进行处理,会污染大气、水体和土壤,不利于改善环境,故C错误;
D.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故D正确,
故选D.
点评 本题考查学生元素以及化合物的性质和应用知识,属于综合知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
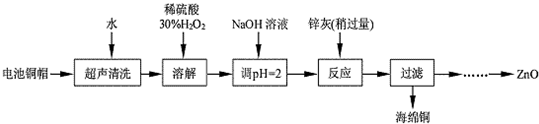
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
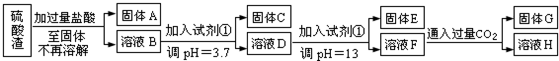
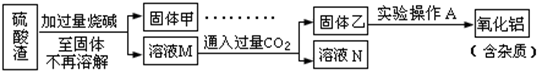
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
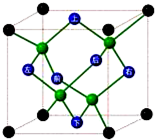 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知: cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.
cm,则晶体的密度为$\frac{ρ}{64}$g/cm3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com