

 ,c(OH-)=c(NaOH)=
,c(OH-)=c(NaOH)= =0.1mol/L,c(H+)=
=0.1mol/L,c(H+)= =10-11mol/L,所以溶液的pH=11,故答案为:11;
=10-11mol/L,所以溶液的pH=11,故答案为:11;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
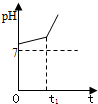 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=查看答案和解析>>
科目:高中化学 来源: 题型:
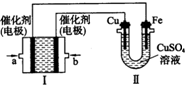 (2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
(2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(N3H)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省瑞安中学高二下学期3月适应性考试化学试卷(带解析) 题型:填空题
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中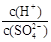 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中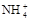 的平衡浓度,c(
的平衡浓度,c(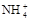 )平=
)平=
查看答案和解析>>
科目:高中化学 来源:浙江省月考题 题型:计算题
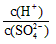 的比值为_______________。
的比值为_______________。 )、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c(
)、c(H+)及氨水的Kb值、水的Kw值表示该溶液中的平衡浓度,c( )平 =___________________。
)平 =___________________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com