
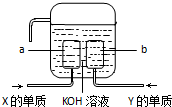
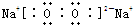 ,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4,
,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4, ;H2O2+SO2=H2SO4;
;H2O2+SO2=H2SO4;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.①②③ | C.②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
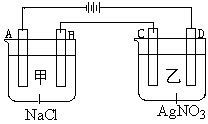
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
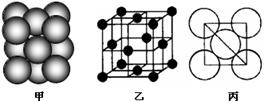
| | | | |||||||||||||||
| | | | | | A | | | | |||||||||
| | | B | | | C | | | ||||||||||
| | | | | | | D | E | | | | | | | | | | |
| 元 素 | D | E | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
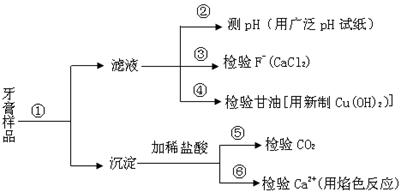
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性:Y>Z |
| B.原子半径:X>Z>Y |
| C.X的最高价氧化物对应的水化物呈碱性 |
| D.X2O、YO2两种氧化物含有的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| X | Y | ||
| Z | W | M |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CBr2F2 | B.CH3CH2OH |
| C.CH3CH2CH3 | D.CH3CH(OH)COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com