
| A. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 石油的分馏和煤的干馏都是发生了物理变化 | |
| D. | 用 CH3CH218OH 与乙酸反应制取乙酸乙酯,18O 存在于水中 |
分析 A.比例模型既能表示分子的空间结构,又能表示出分子中各原子的相对大小,与分子的真实结构最接近;
B.醇的催化氧化中O-D键断裂、与羟基相连C上的C-H键断裂;
C.煤的干馏生成煤焦油等;
D.酯化反应中羧酸脱-OH,醇脱H.
解答 解:A.比例模型 可以表示甲烷分子,但Cl原子半径大于C原子半径,不能表示四氯化碳分子,故A错误;
可以表示甲烷分子,但Cl原子半径大于C原子半径,不能表示四氯化碳分子,故A错误;
B.醇的催化氧化中O-D键断裂、与羟基相连C上的C-H键断裂,则反应为2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO,故B正确;
C.石油的分馏与沸点有关,无新物质生成,为物理变化,而煤的干馏有新物质生成,为化学变化,故C错误;
D.CH3CH218OH 与乙酸反应制取乙酸乙酯,18O 存在于醇、酯中,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应、官能团与性质为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CO2+C(红热)═2CO | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱溶液的pH大于7,Ba(OH)2是碱,所以氢氧化钡溶液的pH大于7 | |
| B. | 点燃H2和O2混合气体可能爆炸,所以点燃H2与CO的混合气体也可能爆炸 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素、氢元素和氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2(g)═SO2(g);△H1 S(g)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
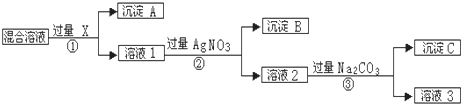
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
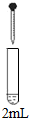 | 0.2mol/L Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ产生白色沉淀 |
| 0.2mol/LCuSO4溶液 | Ⅱ溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1mol/LAl2(SO4)3溶液 | Ⅲ开始无明显变化,继续滴加产生白色沉淀 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2K(s)+2H2O(1)═2KOH(aq)+H2(g)△H1,2Na(s)+2H2O(1)═2NaOH(aq)+H2(g)△H2,则△H1>△H2 | |
| B. | Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H1,Ca(s)+2HCl(aq)═CaCl2(aq)+H2(g)△H2,则△H1>△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g),H2(g)+Br2(g)═2HBr(g)△H2,则△H1>△H2 | |
| D. | 2Fe(s)+3Br2(g)═2FeBr3(s)△H1,2Fe(s)+3Cl2(g)═2FeCl3(s)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、I- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32- | |
| D. | 在pH为7的溶液中:Ag+、K+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com