
 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、向Al2(SO4)3溶液中通入NH3 |
| B、向NaHCO3溶液中滴入烧碱溶液 |
| C、向淀粉-KI溶液中通入NO2气体 |
| D、向含酚酞的NaOH溶液中通入SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
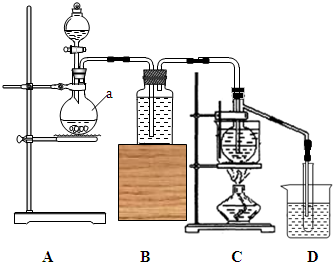 实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))
实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
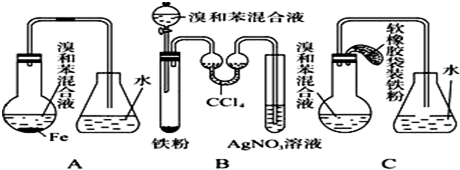
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
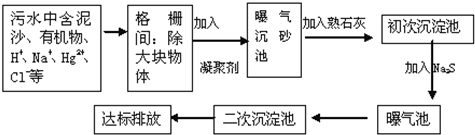
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、④⑤⑥⑧ |
| C、除④⑧外 | D、⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把少量铜屑放入稀硝酸中:Cu+4H++2 NO3-═Cu2++2NO2↑+2H2O |
| B、将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| C、在NaOH浓溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3↑+H2O |
| D、将少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com