
【题目】下列说法中正确的是 ( )
A. 淀粉和纤维素都是纯净物
B. 油脂都不能使溴的四氯化碳溶液褪色
C. 蔗糖和淀粉都不能使新制氢氧化铜在加热条件下还原成红色沉淀
D. 羊毛、棉花的主要成分都是蛋白质
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B,B能与纯碱反应。已知:
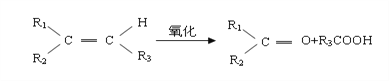
则符合上述条件的烃A有 ( ) 种(不考虑顺反异构)。
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知标准状况下,m1 g气体G1与m2 g气体G2的分子数相同,则:
(1)同温同压下G1和G2的密度比为___________(用m1、m2表示);
(2)同温同质量的G1和G2的分子数比为____________(用m1、m2表示);
(3)同温同压下同体积G1和G2的质量比为____________(用m1、m2表示);
(4)两密闭容器,若温度、密度相同(m1>m2),则其压强(p)G1________G2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R(OH)2和W(OH)2均难溶于水,且R2+和W2+均能水解,常温下,R(OH)2和W(OH)2饱和溶液中,金属阳离子的p(M2+)[p(M2+)=-lgc(M2+)]随溶液pH的变化关系如右图所示。已知:Ksp[R(OH)2]sp[W(OH)2]。则下列说法中错误的是( )
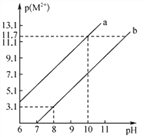
A. a线表示饱和溶液中p(R2+ )随溶液pH变化关系
B. R(OH)2和W(OH)2沉淀共存的溶液中存在![]() =104.6
=104.6
C. 常温下,R(OH)2在饱和W(OH)2溶液中的溶解度比在纯水中的小
D. 若RSO4溶液中含有少量W2+,可加入适量RCO3除去W2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
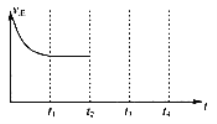
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示有关生物大分子的简要概念图,下列叙述正确的是( )
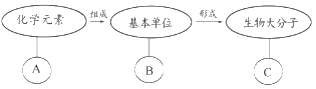
A. 若B为葡萄糖,则C在动物细胞中可能为乳糖
B. 若C为RNA,则B为核糖核苷酸,A为C、H、O、N
C. 若C具有信息传递、运输、催化等功能,则B可能为氨基酸
D. 若B为核糖核苷酸,则C可能存在于线粒体、叶绿体、染色体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是生物体内四种有机物的组成与功能关系图,有关叙述不正确的是 ( )
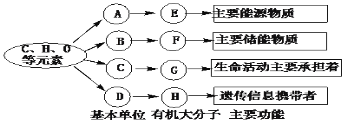
A. 玉米种子细胞中,物质A和E分别代表葡萄糖和纤维素
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 在人体细胞中物质C约有20种
D. 不同的H在结构上的区别主要是碱基的排列顺序不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
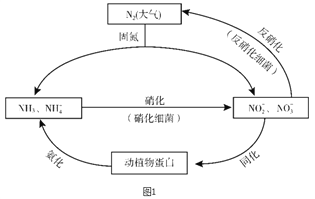
(1)结合上图判断下列说法正确的是________(填字母序号)。
A. 固氮过程中,N2只做氧化剂
B. 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C. 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D. 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的反应的化学方程式为_______。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:5CH3OH + 6NO3- ![]() N2↑ + 4HCO3- +□______+□
N2↑ + 4HCO3- +□______+□
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:_______。
共价键 | N≡N | H—H | N—H |
断开1mol共价键所需能量(kJ) | 946 | 436 | 391 |
(5)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图2和图3所示。
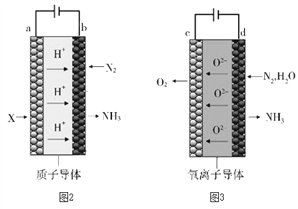
①图2中,a电极上通入的X为_______。
②图3中,d电极上的电极反应式为_______。
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制460mL0.1mol/LNaOH溶液,回答下列问题:
(1)完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、量筒、_____、_____等。
(2)应用托盘天平称取NaOH固体的质量为_________。
(3)下面操作造成所配NaOH溶液浓度偏高的是_________________
A .将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
B .摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C .定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未干燥处理
E. NaOH固体放在烧杯中称量时间过长
(4)取上述体积均为150mL的 A、B 两份NaOH 溶液,分别通入一定量的 CO2 后,再向所得溶液中滴加一定物质的量浓度的盐酸 , 产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
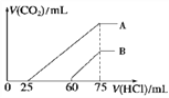
①B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
②A 曲线表明,盐酸的浓度为______mol/L;通入的CO2在标准状况下的体积为______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com