
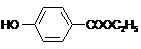 ,生产过程如下图:
,生产过程如下图:
 的分子式为
的分子式为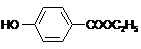 中的含氧官能团名称是
中的含氧官能团名称是 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是 的分子式为C8H10O,从耗氧的角度其分子式可写成C8H8?H2O,由此判断耗氧量;
的分子式为C8H10O,从耗氧的角度其分子式可写成C8H8?H2O,由此判断耗氧量;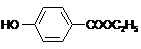 中的含有(酚)羟基和酯基,酚羟基与氢氧化钠反应,酯基发生水解,生成的羧基也与氢氧化钠反应;
中的含有(酚)羟基和酯基,酚羟基与氢氧化钠反应,酯基发生水解,生成的羧基也与氢氧化钠反应; 中的羧基与乙醇发生酯化反应;
中的羧基与乙醇发生酯化反应; ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO. 的分子式为C8H10O,从耗氧的角度其分子式可写成C8H8?H2O,据此可知1molC8H8?H2O完全燃烧消耗 10molO2,
的分子式为C8H10O,从耗氧的角度其分子式可写成C8H8?H2O,据此可知1molC8H8?H2O完全燃烧消耗 10molO2,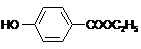 中的含有(酚)羟基和酯基,酚羟基与氢氧化钠反应,酯基发生水解,生成的羧基也与氢氧化钠反应,所以1mol 该物质与NaOH溶液完全反应,最多消耗2molNaOH,
中的含有(酚)羟基和酯基,酚羟基与氢氧化钠反应,酯基发生水解,生成的羧基也与氢氧化钠反应,所以1mol 该物质与NaOH溶液完全反应,最多消耗2molNaOH, 中的羧基与乙醇发生酯化反应,反应方程为
中的羧基与乙醇发生酯化反应,反应方程为 ,属于取代反应,
,属于取代反应, ;酯化反应(或取代反应);
;酯化反应(或取代反应); ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO,即X为-OH、-CH2OH 或-OCH3,
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,含有醛基,X为-OH时,Y为-CH2CH2CHO或-CH(CH3)CHO,X为-CH2OH或-OCH3时,Y为-CHO,即X为-OH、-CH2OH 或-OCH3,

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
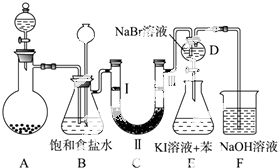 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g | B、4.2g |
| C、11.2g | D、5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH与CH3COO-的浓度之和减小为原来的0.1 |
| B、CH3COO-与CH3COOH的浓度之比增大为原来的10倍 |
| C、CH3COO-与H+的浓度之积减小为原来的0.1 |
| D、CH3COOH的电离平衡常数增大为原来的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 用品 | 食盐 | 小苏打 | 明矾 | 漂白粉 |
| 有效成分 | NaCl | Na2CO3 | KAl(SO4)2?12H2O | Ca(ClO)2 |
| 用途 | 做调味品 | 做发酵粉 | 净水剂 | 做消毒剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com