
实验室制Cl2反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O下列说法不正确的是( )
MnCl2+Cl2↑+2H2O下列说法不正确的是( )
A.还原剂是浓HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子2mol
C.每消耗1mol MnO2,浓HCl被还原4mol
D.转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L
科目:高中化学 来源: 题型:
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( )
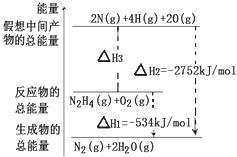
|
| A. | 194 | B. | 391 | C. | 516 | D. | 658 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
|
|
 (R、R’代表烃基)
(R、R’代表烃基) (1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol  与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中可以大量共存的离子组是( )
A.Na+、NO3-、Mg2+、Cl- B.Na+、CO32-、NO3-、Ca2+
C.K+、Cl-、SO42-、Cu2+ D.Ba2+、Cl-、K+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为NA个
B.24g金属镁变为镁离子时失去的电子数为NA个
C.在0℃、101kP时,28gN2和CO的混合气体,其体积约为22.4L
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.1铁和铝的混合粉末溶于200mL、5mol/L的盐酸中,反应后盐酸的浓度变为4.6mol/L,若忽略溶液体积的变化,试计算:
(1)原混合物中铁和铝的质量各为多少?
(2)反应后产生的气体在标准状况下的体积多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是 ( )
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:
3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
 (2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
判断的依据是: 。(3分)
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1= 。(3分)
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为 。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号) (3分)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新 工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确 的是( )

A.X为直流电的负极,Y为直流电的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com