
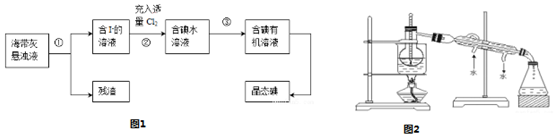
分析 Ⅰ.淡化海水的方法有加热蒸发、结冰脱盐、淡化膜法、多级闪急蒸馏法、离子交换法,共同点都是使海水脱盐,以此来解答;
Ⅱ.以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中通入足量Cl2,发生反应为2I-+Cl2=2Cl-+I2,向含有碘单质的溶液中加入萃取剂四氯化碳萃取蒸馏得到碘单质,
(1)根据固体灼烧需要在坩埚中进行,结合仪器的作用选取仪器;
(2)分离不溶性固体和溶液采用过滤的方法,从碘水中获得碘采用萃取的方法;
(3)根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式;
(4)a.倒转漏斗用力振荡,使也液体充分混合后萃取分液;
b.其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体;
(5)碘单质遇到淀粉会变蓝色来检验是否还有碘单质;
(6)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平.
解答 解:Ⅰ.A.过滤法只能除去水中的不溶性杂质,而海水淡化的过程是除去海水中的可溶性杂质,通过过滤不能把水中的氯化钠等物质除去,不能使海水淡化,故A错误;
B.蒸馏法是把水从水的混合物中分离出来,得到纯净的水,故B正确;
C.膜分离法,可使小分子通过高分子膜,可用于海水淡化,故C正确;
D.离子交换法可用于海水淡化,故D正确.
故答案为:BCD;
Ⅱ.(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台或三脚架、泥三角、酒精灯;
故答案为:BCDE;
(2)操作①是将溶液和不溶性固体分离的方法是过滤,操作③是从碘水中获取碘单质采用萃取、分液的方法,
故答案为:过滤;萃取、分液;
(3)过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(4)a.上述D步操作中倒转漏斗用力振荡的目的是:使两种液体充分接触,
故答案为:使两种液体充分接触;
b.其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体,所以其操作顺序是CBDAHGEF;
分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,便于液体流出,
故答案为:CBDAHGEF;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘,
故答案为:取少量提取的碘后的水溶液于试管中,加入几滴淀粉溶液,观察是否出现蓝色,如果变蓝色,说明还有单质碘;
(6)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平,
故答案为:C.
点评 本题考查海水资源的综合利用,涉及物质分离提纯方法、萃取剂的选取标准等知识点,明确物质的性质是解本题关键,知道实验操作步骤,知道萃取剂的选取方法,掌握过滤、萃取、蒸馏等操作是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
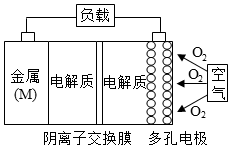 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )| A. | 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH- | |
| B. | 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 | |
| D. | 与铝一空气电池相比,镁一空气电池的比能量更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol C2H2(g)完全燃烧生成气态水时放热大于2600kJ | |
| B. | 2mol C6H6(1)完全燃烧生成液态水时放热大于6590kJ | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
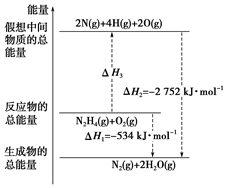 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )| A. | 194 | B. | 391 | C. | 516 | D. | 685 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com