
)如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
(1) 一段时间后,甲中溶液颜色 ,
写出甲中C的电极反应式 。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3) 现用丙装置给铜件镀银,电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是 。
(1) 逐渐变浅 4OH-—4e-=O2↑+2H2O
(2) 1∶2∶2∶2 (3) AgNO3 5.4 g
(4) 2Cl- + 2H2O  2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑
解析试题分析:这是一道有关电解的试题,甲、乙、丙三个电解池中,在讨论其中任何一个的时候,另外两个都当做导线来处理,将直流电源接通后,F极附近呈红色,说明F极是氢离子放电,那么F极就是乙电解池的阴极,对应的B就是电池的负极,A就是原电池的正极,连接A电极的C电极就是思解池甲的阳极,由于C、D、E、F都是惰性电极,电极本身不参与电极反应,因此在C极上应该是溶液中的阴离子放电,所发生的电极反应为:4OH-—4e-=O2↑+2H2O,在D极上电极反应为:Cu2++2e-=Cu,溶液的颜色变浅;若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,C上生成氧气,D上生成铜单质,E上生成氯气,F上生成氢气,因为它们彼此串联,在相同的时间内通过的电量相等,那么,在各个电极上对应单质的物质的量之比为1﹕2﹕2﹕2;用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500 mL),表明溶液中通过的电子为0.05mol,电镀液是含有银离子的溶液,这个时候所发生的总的反应的离子方程式是:Ag++e-=Ag,可以看出生成银单质的质量为:0.05mol×108g/mol=5.4 g。若将F电极更换为铁,其他装置都不变,因为铁是阴极,不参与电极反应,则乙中发生总反应的离子方程式和没换之前是一样的。
考点:考查电解的有关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)铁在潮湿的空气中容易发生电化腐蚀最后生成铁锈(Fe2O3.xH2O),则发生腐蚀时正极上发生反应的电极反应式为__________________。
(2)下列哪些装置可防止铁棒被腐蚀__________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀。装置示意图如下左图:
①电镀时,镀件与电源的______________极连接,A电极对应的金属是______________(写元素名称),B电极的电极反应式是______________________。
②上右图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和
隔膜,该电池反应为 。该电池正极的电极反应式为___________________________。
。该电池正极的电极反应式为___________________________。
用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.合理饮食和正确用药,是人体健康的重要保证。
现有下列五种物质A食盐;B小苏打;C苹果汁;D葡萄糖;E青霉素,请按下列要求填空(填序号)。
富含维生素C的是 ,可直接进入血液,补充能量的是 ,应用最广泛的抗生素之一的是 ,既可作为疏松剂,又可治疗胃酸过多的是 ,食用过多会引起血压升高、肾脏受损的 。
Ⅱ.钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)写出工业上用赤铁矿炼铁的主要化学反应方程式: 。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:
①铁锅的腐蚀主要是由 (填化学或电化学)腐蚀造成的。形成的铁锈的主要成分是 。
②为防止轮船的船体在海水中腐蚀,一般在船身连接 (填“锌块”或“铜块”)。
Ⅲ.材料是人类赖以生存和发展的重要物质基础,合理使用材料可以改善我们的生活。
(1)体育场馆建设需大量建筑材料。下列材料不属于硅酸盐材料的是 (填字母)。
A.石灰石 B.水泥 C.玻璃
(2)在下列材料中,属于无机非金属材料的是 (填字母)。属于塑料制品的是 。
A.涤纶 B.聚氯乙烯塑料 C.氮化硅陶瓷 D.玻璃钢
(3)下列有关合金性质的说法正确的是 (填字母)。
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
(4)合成塑料、合成橡胶和 是常说的三大合成材料。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外活动小组同学用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。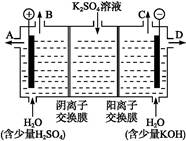
①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: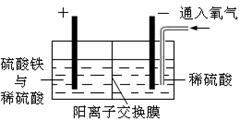
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑ 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是 。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,按要求回答下列问题:
(1)放电时, _______(填物质化学式,下同)作负极,充电时,____________作阴极。
(2)放电时正极附近溶液的碱性__________ (填“增强”或“减弱”)
(3)充电时,每转移3mol电子,被氧化物质的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答:
①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分。
(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:①Na2CO3溶液 ②HCl(盐酸) ③Ba(OH)2溶液,这三种试剂的添加顺序是_________(填序号)。
(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:__________。
(3)某同学设计了如图装置进行以下电化学实验。
①当开关K与a连接时,两极均有气泡产生,则阴极为_______极。
②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为__________。请写出此时Fe电极上的电极反应式_________________。
(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好。再通入CO2,则逐渐产生大量(NH4)2SO4。请分析其原因 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com