
如图为锌铜显示原电池装置图,下列说法不正确
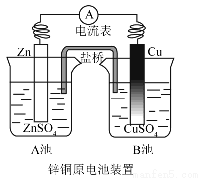
A.电子由Zn极流向Cu极
B.该装置的总反应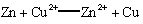
C.一段时间后,A池带正电荷,B池带负电荷
D.取出盐桥,电流计指针不再偏转
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为
A.57 B.47 C.61 D.293
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三4月联考理综化学试卷(解析版) 题型:实验题
(14分)Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s)△ Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
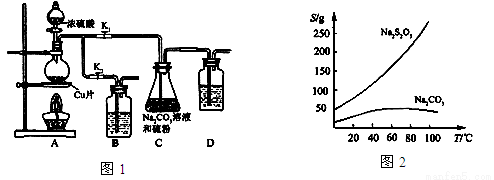
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为____ mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省八校联盟高三第二次联考理综化学试卷(解析版) 题型:选择题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计),则下列说法错误的是
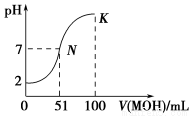
A.常温下,MA的水溶液的pH=a,由水电离产生的c(H+)=1×10-a mol·L-1
B.在K点,水溶液中存在:c(M+) = 2c(A-)
C.在N点,水溶液中存在:c(M+) + c(H+)= c(A-)+ c(OH-)
D.在K点,若此时溶液的pH=10,则c(MOH)+c(M+)=0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市朝阳区高三4月第一次综合练习理综化学试卷(解析版) 题型:填空题
(13分)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
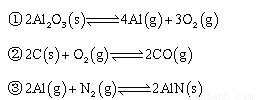
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
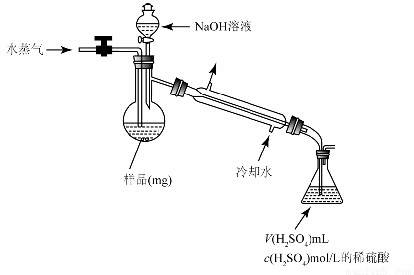
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为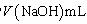 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量: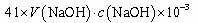
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: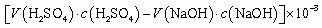
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一下学期学期第一次月考化学试卷(解析版) 题型:计算题
(15分)某研究性学习小组通过测量镁铝合金和盐酸反应生成气体体积的方法来测定合金的成分,他们取10.2 g镁铝合金与盐酸恰好完全反应,反应后收集得11.2 L氢气(已转换成标准状况),试求:
(1)反应过程中消耗盐酸的物质的量
(2)10.2 g合金中镁的质量。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一下学期学期第一次月考化学试卷(解析版) 题型:选择题
A元素的最高正价和最低负价的绝对值之差为6,B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是
A.MgF2 B.CaCl2 C.K2S D.Na2O
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二下学期学期第一次月考化学试卷(解析版) 题型:选择题
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br -,然后Br+ 首先与CH2=CH2一端碳原子结合,第二步才是Br -与另一端碳原子结合。根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一4月月考文化学试卷(解析版) 题型:选择题
下列各组物质的性质顺序,不正确的是
A.原子半径:Na<Mg<Al B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.熔点:SiO2>NaCl>CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com