
下列气体中,可以用碱石灰干燥的是 ( )
A.CO2 B.Cl2 C.NH3 D.SO2
科目:高中化学 来源:2016届山东省泰安市高一上学期期末考试化学试卷(解析版) 题型:选择题
从人类健康或生活实际的角度考虑,下列叙述正确的是
A.用铝锅可长时间盛放酸性食物 B.氯气泄漏后应顺风向低处跑
C.食用“加碘”食盐不利于健康 D.用食醋可除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源:2016届山东省威海市高一上学期期末考试化学试卷(解析版) 题型:选择题
酸雨严重地威胁着地球生命生存的生态环境。下列有关减少或者防止酸雨形成的措施不可行的是
A.对燃煤进行脱硫,减少向大气排放SO2
B.为增加工业产值,大力兴建水泥厂、炼钢厂
C.对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
D.对汽车等交通工具采用清洁燃料,如天然气、甲醇等
查看答案和解析>>
科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
将饱和溶液FeCl3加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明,来区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
下列变化需要加入适当的氧化剂才能完成的是 ( )
A.CuO→Cu B.HNO3→NO
C.Na2SO3→SO2 D.FeCl2→FeCl3
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一教学评估(一)化学试卷(解析版) 题型:填空题
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式 ;
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(3)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的 。
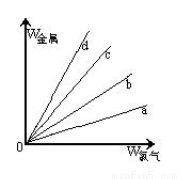
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一教学评估(一)化学试卷(解析版) 题型:选择题
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A.①=② B.①>② C.①<② D.不能确定
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
(1)按要求写出化学式。
①石灰石的主要成分 ;②纯碱 ;
③漂白液的有效成分 ;④硅石的主要成分 。
(2)将下列7个反应分成两类:
①白色的Fe(OH)2先变成灰绿最后变成红褐色;
②NaOH腐蚀玻璃;
③铝屑溶于NaOH溶液;
④小苏打受热分解;
⑤NO2被水吸收;
⑥NH4Cl与熟石灰反应;
⑦高炉炼铁
第一类是 ;第二类是 。(填序号)
分类依据是 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:填空题
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | |||
第一次 | 第二次 | 第三次 | ||
0.02 | 14 | 13 | 11 | |
0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液 | H2C2O4溶液 | ||
浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
0.02 | 2 | b | 4 |
a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
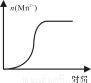
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com