
【题目】下列现象或事实可用同一原理解释的是![]()
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.![]() 和
和![]() 溶液使酸性高锰酸钾的紫色褪去
溶液使酸性高锰酸钾的紫色褪去
C.漂白粉和水玻璃长期暴露在空气中变质
D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质。
(1)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=﹣905.5kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180kJ/mol
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式 。
(2)电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应是 。
(3)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(4)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是__________。
②用H2催化还原法可降低水中NO![]() 的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.O2、O3是氧元素的同素异形体,两者都为非极性分子
B.35Cl与37Cl互为同位素
C.乙二醇( ![]() ) 和甘油(
) 和甘油(![]() )互为同系物
)互为同系物
D.CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)可与重金属盐产生沉淀,是目前应用较多的一种新型水处理剂。利用精钼矿![]() 主要成分是MoS2,含少量PbS等
主要成分是MoS2,含少量PbS等![]() 来制取钼酸钠晶体的工艺流程如下图所示。
来制取钼酸钠晶体的工艺流程如下图所示。
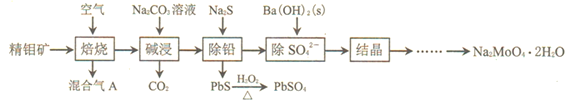
请回答下列问题:
⑴混合气A中含有一种大气污染物,其化学式为___________。
⑵焙烧的过程中采用如图1所示的“多层逆流焙烧”。
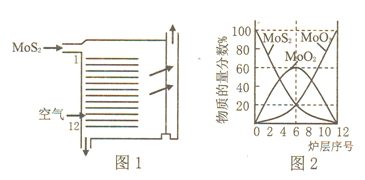
①多层逆流焙烧的优点是___________![]() 任答两点
任答两点![]() 。
。
②依据如图2,写出第6—12层MoO2参加反应的化学方程式___________。
⑶写出碱浸时发生反应的离子方程式___________。
⑷PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是___________。
⑸流程图中“除SO42-”的过程中,当BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L,Ksp(BaSO4) = 1.0×10-10,则Ksp(BaMoO4) = ___________。![]() 过程中溶液体积变化忽略不计
过程中溶液体积变化忽略不计![]()
⑹锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是___________。
Lix(MoS2)n,则电池放电时的正极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约为21%)的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍的工艺流程如下:
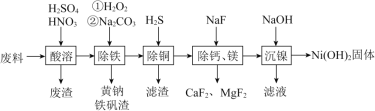
回答下列问题:
⑴合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应生成的气体只有N2。写出金属镍溶解的离子方程式:_______。
⑵“除铁”时H2O2的作用是__________,为了证明添加的H2O2已足量,应选择的试剂是__________(填“铁氰化钾”或“硫氰化钾”)溶液。
⑶“除铜”时,反应的离子方程式为__________,若用Na2S代替H2S除铜,优点是__________。
⑷已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是__________。
⑸镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M + Ni(OH)2![]() MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
MH + NiOOH(式中M为储氢合金),写出电池放电过程中正极的电极反应式:__________。
⑹已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组为测定黄钠铁矾的组成,进行了如下实验:
步骤Ⅰ.称取4.850g黄钠铁矾样品,加盐酸完全溶解后,配成100.00mL溶液A;
步骤Ⅱ.量取25.00mL溶液A,加入足量的KI,用0.2500 mol·L-1的Na2S2O3溶液进行滴定(反应为I2 + 2Na2S2O3 = 2NaI + Na2S4O6 ),滴定至终点时消耗30.00mL Na2S2O3溶液。
步骤Ⅲ![]() 另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
①用Na2S2O3溶液进行滴定时,使用的指示剂为__________,滴定达到终点时的颜色变化为__________。
②黄钠铁矾的化学式为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式(有机物写结构简式),在括弧中填反应类型。
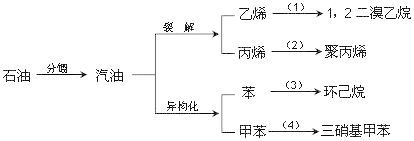
(1)__________,(_______);
(2)__________,(_______);
(3)__________,(_______);
(4)__________,(_______)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),则下列叙述中正确的是( )
4NO(g)+6H2O(g),则下列叙述中正确的是( )
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成nmolNO的同时,生成nmolNH3,则反应达到平衡状态
C.若NH3、O2、NO、H2O的分子数之比为4∶5∶4∶6时,反应达到化学平衡状态
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )

A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com