
分析 (1)反应2FeCl3+Cu═2FeCl2+CuCl2中,Fe元素化合价降低,被还原,FeCl3为氧化剂,Cu元素化合价升高,被氧化,Cu为还原剂;
(2)化合价降低元素所在的反应物是氧化剂,对应产物是氧化产物,化合价升高元素所在的反应物是还原剂,对应产物是氧化产物;
(3)根据方程式和转移电子的量来计算;
(4)根据离子方程式的书写方法来回答,三种盐均为易溶于水的强电解质,要写成离子;
(5)在溶液中完全电离出铁离子和氯离子.
解答 解:(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,双线桥法表示电子转移的方向和数目如下: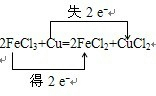 ,故答案为:
,故答案为: ;
;
(2)化合价降低元素Fe元素所在的反应物FeCl3是氧化剂,对应产物FeCl2是还原产物,化合价升高元素Cu所在的反应物是还原剂,对应产物CuCl2 是氧化产物,
故答案为:FeCl3;CuCl2;
(3)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,
故答案为:9.6g;
(4)反应2FeCl3+Cu=2FeCl2+CuCl2改为离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(5)在溶液中完全电离出铁离子和氯离子,则FeCl3的电离方程式为FeCl3=Fe3++3Cl-;故答案为:FeCl3=Fe3++3Cl-.
点评 本题综合考查氧化还原反应的概念和计算、以及离子方程式的书写,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度分析氧化还原反应的相关概念和物质的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子很小,可以透过半透膜 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| D. | 豆浆、雾、有色玻璃都是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
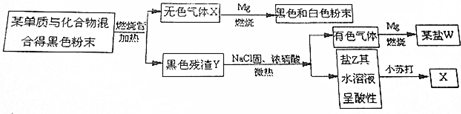
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com