
分析 (1)D为质子数为1,中子数为1的氢原子,水分子中存在两个氧氢键;
(2)化学反应的实质是旧键的断裂和新键的形成,断键要吸收能量,成键要放出能量.
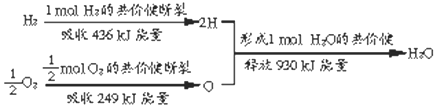
(3)上图表示了1mol氢气和0.5mol氧气反应生成1mol水蒸气的过程中的能量变化,断键吸收能量,成键释放能量,△H=反应物键能和-生成物键能和,水蒸气变成液态水,放热据此解答.
解答 解:(1,1个D218O含质子数为10,中子数为12,在1molD218O中,含有的中子数为,2mol,水分子中存在两个氧氢键,氧与氢原子间有一个共用电子对,D218O结构式为:D-O-D,所以1molD218O中含有2mol O-D键,
故答案为:12mol;2;
(2)化学反应的实质是旧键的断裂和新键的形成,断键要吸收能量,成键要放出能量,由H原子形成1mol H-H 键,要放出436KJ的能量,而断开1mol H-H键重新变为H原子,要吸收 436KJ的能量,若要使2mol氢分子变为氢原子时,需要吸收 436KJ×2=872KJ的能量
故答案为:吸收;872;
(3)A.氢气燃烧生成水蒸气,△H=反应物键能和-生成物键能和=436KJ/mol+249KJ/mol-930KJ/mol=-245KJ/mol,氢气和氧气反应生成1molH2O液态水放出的热量大于245kJ,故A正确;
B.由A可知氢气和氧气反应生成1molH2O液态水放出的热量大于245kJ,故B错误;
C.由A可知氢气和氧气反应生成1molH2O液态水放出的热量大于245kJ,故C错误;
D.氢气吸收能量变化为氢原子,氧气吸收能量变化为氧原子,所以2molH和1molO所具有的能量大于1molH2和$\frac{1}{2}$molO2所具有的总能量,故C正确;
E.氢气燃烧是放热反应,反应物能量高于生成物的能量,1mol氢气和$\frac{1}{2}$mol氧气的总能量大于1mol水的能量,选项中未指明物质的量,不能确定能量大小,故D错误;
F.断键吸收能量,1molH2O气态水分解为氢气和氧气吸收的热量为245kJ,1molH2O液态水分解为氢气和氧气吸收的热量大于245kJ,故F错误;
故选AD.
点评 本题考查了化学反应中的能量变化,注意把握化学反应中断键要吸收能量,成键要放出能量,注意△H=反应物键能和-生成物键能和,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:烧碱、纯碱、苛性钾、氢氧化钡 | |
| C. | 混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O、CaO、MgO、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胃酸过多的病人都可以服用氢氧化钠、氢氧化铝、碳酸钠等中和胃酸的药 | |
| B. | 使用青霉素时,不用进行皮试可直接静脉注射 | |
| C. | 阿司匹林是一种治感冒药,具有解热镇痛作用 | |
| D. | 麻黄碱有止咳平喘的作用,运动员比赛前若身体不适可服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,6.4gSO2含有的氧原子数为0.2NA | |
| B. | 标准状况下,22.4LCCl4分子中氯原子数为4NA | |
| C. | 2L0.1mol•L-1Na2SO4溶液中含Na+离子数为0.4NA个 | |
| D. | 2.7g金属铝与足量稀硫酸反应生成H2分子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水时HCl是强酸而H2S是弱酸 | B. | 常温下Cl2为气体,S单质为固体 | ||
| C. | 单质S可以在空气中燃烧Cl2不能 | D. | HCl比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105 Pa时,11.2 L氮气所含的原子数目为NA | |
| B. | 常温下,1 L 0.1 mol/L的Na2CO3溶液中含有的离子总数为0.3 NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23 g钠充分燃烧时转移电子数为1 NA | |
| D. | 1 mol P4和1 mol CH4中含有的共价健数均为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com