

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

 Fe2(OH)42+ + 2H+ (3分)(5)D (2分)(6)5.6 (2分) 偏高 (2分)
Fe2(OH)42+ + 2H+ (3分)(5)D (2分)(6)5.6 (2分) 偏高 (2分) [Fe2(OH)4]2++2H+;(5)检验所得产品中是否含有Fe2+,可使用酸性KMnO4溶液;(6)根据所给反应可得关系式Fe3+~S2O32-,所以n(Fe3+)=n(Na2S2O3)=0.1000mol/L×0.020L=0.0020mol,溶液中铁元素的总含量为0.0020mol×56g/mol÷0.020L=5.6g/L;若滴定前溶液中H2O2没有除尽,则H2O2也可氧化I-得到I2,消耗的Na2S2O3将偏多,导致所测定的铁元素的含量偏高。
[Fe2(OH)4]2++2H+;(5)检验所得产品中是否含有Fe2+,可使用酸性KMnO4溶液;(6)根据所给反应可得关系式Fe3+~S2O32-,所以n(Fe3+)=n(Na2S2O3)=0.1000mol/L×0.020L=0.0020mol,溶液中铁元素的总含量为0.0020mol×56g/mol÷0.020L=5.6g/L;若滴定前溶液中H2O2没有除尽,则H2O2也可氧化I-得到I2,消耗的Na2S2O3将偏多,导致所测定的铁元素的含量偏高。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
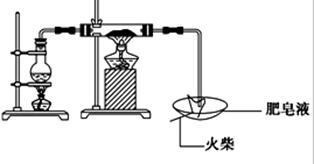
| | 实验步骤 | 预期现象与结论 |
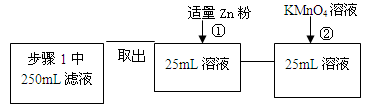
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列说法正确的是
下列说法正确的是| A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| B.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.制备碱式硫酸铁利用了过氧化氢的氧化性 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原混合物中CuO与Fe2O3物质的量的比为1∶2 |
| B.原混合物中CuO与Fe2O3的质量比为2∶1 |
| C.吸收CO2后溶液中一定有Ba(HCO3)2 |
| D.反应中生成的CO2体积为1.792 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
|
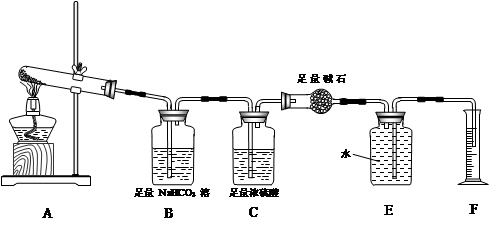 【实验过程】
【实验过程】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com