
现称取27.6 g白云石,加热到质量不再变化,收集到的CO2为6.72 L(已换算成标准状况)。
(1)试写出白云石的化学式______________________(取x、y的最小整数比)。
(2)已知:CaO+3C![]() CaC2+CO↑;2MgO+5C
CaC2+CO↑;2MgO+5C![]() Mg2C3+2CO↑。若称取已研细的白云石m g与过量的炭粉混合,放在特定容器中隔绝空气强热一段时间后,测得白云石的分解率为a,生成CO的体积为V L(已换算成标准状况)。试求V与a的关系。
Mg2C3+2CO↑。若称取已研细的白云石m g与过量的炭粉混合,放在特定容器中隔绝空气强热一段时间后,测得白云石的分解率为a,生成CO的体积为V L(已换算成标准状况)。试求V与a的关系。
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2013届湖北省部分重点中学(天门中学等)高三上学期期中联考化学试卷(带解析) 题型:填空题
(6分) 氯气在生产生活中应用广泛。
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的化学方程式 。
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤I中,试剂甲必须具有的性质是 (填序号)。
a. 氧化性 b.还原性 c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷B(解析版) 题型:填空题
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)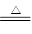 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
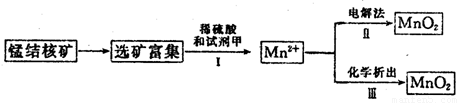
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com