
【题目】下列是部分矿物资源铝土矿(主要含有氧化铝、氧化铁)和黄铜矿(主要成分CuFeS2)的利用及产品生产流程,有关说法不正确的是( )
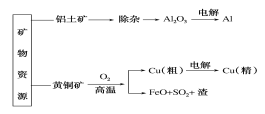
A. 除杂过程中铝元素的存在形式的变化可以如下:Al2O3→AlO2-→Al(OH)3→Al2O3
B. Al和Cu(精)均在电解槽的阴极获得
C. 粗铜炼制过程中反应2CuFeS2+O2![]() Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
D. 若电解法分别制铝和铜的过程中转移电子数相等,理论上获得的铝和铜的物质的量之比为3:2
【答案】D
【解析】
A.铝土矿中氧化铝溶于强碱,除去氧化铁,生成偏铝酸根离子,再通入二氧化碳生成氢氧化铝,过滤、洗涤、干燥灼烧氢氧化铝生成氧化铝,除杂过程中铝元素的存在形式的变化可以如下:Al2O3→AlO2-→Al(OH)3→Al2O3,A正确;
B.Al和Cu(精)在电解精炼时,均为金属离子生成单质,则在电解槽的阴极获得,B正确;
C.粗铜炼制过程中反应2CuFeS2+O2![]() Cu2S+2FeS+SO2,Cu、O的化合价降低,部分S的化合价由-2价变为+4价,得到6个电子,则每转移1.2mol电子,则有0.2mol硫被氧化,C正确;
Cu2S+2FeS+SO2,Cu、O的化合价降低,部分S的化合价由-2价变为+4价,得到6个电子,则每转移1.2mol电子,则有0.2mol硫被氧化,C正确;
D.若电解法分别制铝和铜的过程中转移电子数相等,Al的化合价由+3变为0,Cu的化合价由+2变为0,理论上获得的铝和铜的物质的量之比为2:3,D错误;
答案为D。


科目:高中化学 来源: 题型:
【题目】(1)标准状况下,32gCH4和22.4LCO2的密度之比为_______;物质的量之比为______。
(2)将20gNaOH溶于水得2L溶液,则该NaOH溶液的物质的量浓度为_________;若从中取出100mLNaOH溶液,其中含有的Na+与____molNa2CO3含有的Na+数目相同。
(3)已知标准状况下,现有四种物质:
A.49g H2SO4 B.6.02×1023个H2O C.44.8L CO和CO2混合气体 D.6g H2
其中所含分子物质的量最小的是____________(填字母);所占体积最大的是________(填字母);若C中气体重量为64g,则该混合气体中CO和CO2的体积比为__________________。
(4)标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρ g·mL-1,则所得盐酸溶液中溶质的物质的量为________________,溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
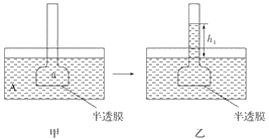

A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
D. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为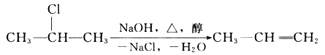
下面是几种有机化合物的转化关系:
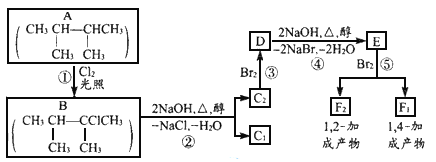
(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C1的结构简式是______________,F1的结构简式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
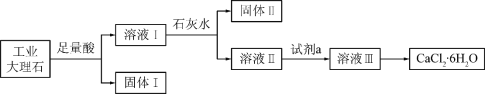
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=___kJ·mol-1(用含a、b的代数式表示);
(2)已知2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1molSO2(g)氧化为1molSO3放出99kJ的热量,请回答下列问题:
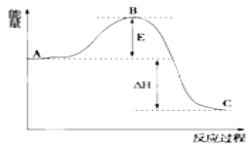
①图中A分别表示____;
②E的大小对该反应的反应热____(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“升高”“降低”)。
Ⅱ.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(3)有机物M经过太阳光光照可转化成N,转化过程如图:
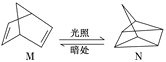 ΔH=+88.6 kJ/mol
ΔH=+88.6 kJ/mol
则M、N相比,较稳定的是___。
(4)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a__238.6(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②KMnO4+ HCl(浓)= KCl+ MnCl2+ Cl2↑+ H2O(未配平)
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目(写在答题卡上)_________________________
(2)配平②___KMnO4+___HCl(浓)=___KCl+___MnCl2+___Cl2↑+___H2O 写出②的离子方程式________________________________;(友情提示:MnCl2易溶于水)②中氧化剂与还原剂分子数之比为_____________。
(3)反应②中氯化氢表现出的性质是________________________。
(4)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液中有关浓度关系不正确的是( )
A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-)
B. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L
D. NH4+浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com