
【题目】R.F.Heck、Ei-ichiNegishi和AkiraSuzuk三名科学家因在钯(Pd)催化交叉偶联反应方面的卓越研究获得2010年诺贝尔化学奖,其中Heck反应的历程如图,下列说法错误的是
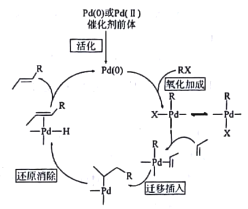
A.Heck反应的总反应类型为取代反应
B.![]() 三中最多有6个原子共平面
三中最多有6个原子共平面
C.![]() 可使溴水或酸性KMnO4溶液褪色
可使溴水或酸性KMnO4溶液褪色
D.若RX为CH3CH2Br,则![]() 的同类别同分异构体还有4种(不考虑立体异构)
的同类别同分异构体还有4种(不考虑立体异构)
【答案】B
【解析】
A. Heck反应是指卤代烃与活化不饱和烃在钯催化下,生成反式产物的反应,R-X+R1CH=CH2→R1CH=CHR+HX,所以反应为取代反应,A正确;
B. ![]() 中,烯平面上共有6个原子共平面,由于单键可以旋转,所以甲基上的一个C-H键可以通过旋转与碳碳双键共面,所以最多有7个原子共平面,B错误;
中,烯平面上共有6个原子共平面,由于单键可以旋转,所以甲基上的一个C-H键可以通过旋转与碳碳双键共面,所以最多有7个原子共平面,B错误;
C. ![]() 中存在碳碳双键,故可以与溴水发生加成反应使其褪色,也可以被酸性KMnO4溶液氧化,从而使KMnO4溶液褪色,C正确;
中存在碳碳双键,故可以与溴水发生加成反应使其褪色,也可以被酸性KMnO4溶液氧化,从而使KMnO4溶液褪色,C正确;
D. 若RX为CH3CH2Br,则![]() 为
为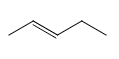 ,要确定与其同类别的同分异构体,则只考虑烯烃,5个C原子的骨架有
,要确定与其同类别的同分异构体,则只考虑烯烃,5个C原子的骨架有![]() 、
、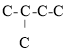 、
、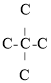 三种情况,而第三种情况不存在烯烃,故不考虑,所以不考虑立体异构,
三种情况,而第三种情况不存在烯烃,故不考虑,所以不考虑立体异构, 的同类别同分异构体还有
的同类别同分异构体还有![]() 、
、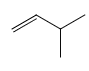 、
、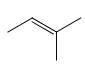 、
、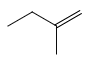 4种,D正确;
4种,D正确;
故答案选B。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,可完成高温下铁与水蒸气反应的实验。
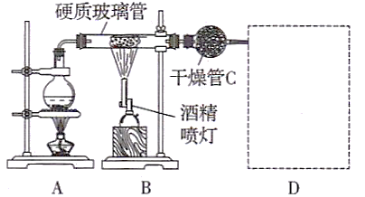
(1)写出有关反应的化学方程式:__________________________。
(2)装置C作用是__________________________。
(3)圆底烧瓶中盛装的是水,该装置的主要作用是_______________;圆底烧瓶底部放了几片碎瓷片,碎瓷片的作用是______________________。
(4)实验开始时应先点燃________________。(填A或B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组做了如下关于钠的探究实验。
探究一:钠与水反应
![]() 该反应的离子方程式_______________________________。
该反应的离子方程式_______________________________。
![]() 用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为
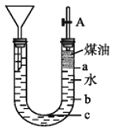
用如图所示的实验装置可以进行钠与水反应的实验,并可收集、检验生成的气体,煤油的密度为![]() 液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在______处(填“a”、“b”或“c”)。
![]() 若实验室要配制480mL0.
若实验室要配制480mL0.![]() NaOH溶液。
NaOH溶液。
①需______gNaOH。
②配制过程中,所用的玻璃仪器除玻璃棒、容量瓶、胶头滴管外,还有______。
③列操作会使所配NaOH溶液浓度偏小的是______(填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后,发现凹液面低于刻度线又加水补上
探究二:钠与氯气反应
![]() 钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
钠在氯气中燃烧的现象:剧烈燃烧, 火焰呈黄色且有______生成。
![]() 在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下
在实验室用浓盐酸与MnO2共热制取Cl2,并进行相关实验。利用上述方法制取标准状况下![]() Cl2,则作还原剂的HCl的物质的量是______。
Cl2,则作还原剂的HCl的物质的量是______。
![]() 粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④用适量盐酸调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发 正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
A.该反应平衡常数的值为1
B.将容器体积变为20L,Z的平衡浓度减小为0.025mol/L
C.以X浓度变化表示的反应速率为0.005mol/(L·s)
D.当X、Y、Z的浓度相等时,证明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10.00mL0.1000mol·L-1H2SO4溶液中滴加相同物质的量浓度的氨水,测得混合溶液中-lgc(OH-)随滴加氨水体积的变化如图所示,下列说法错误的是
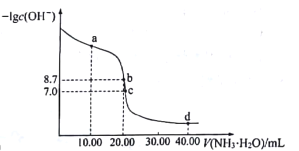
A.水的电离程度:b>c>a
B.Kh(NH4+)的数量级为10-10
C.c点满足c(SO42-)>c(NH4+)>c(H+)=c(OH-)
D.d点满足c(NH4+)+2c(H+)=c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
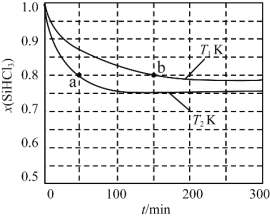
A.该反应为放热反应,v正a<v逆b
B.T1 K时平衡体系中加入Ar气,可使正、逆反应速率均增大
C.当反应进行到a处时,![]() =
=![]()
D.T2 K时平衡体系中再充入1mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com