
| A. | 第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 | |
| B. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| C. | 第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
分析 A.元素金属性越强,最高价氧化物的水化物的碱性越强;
B.同一周期元素,元素的非金属性随着原子序数增大而增强;
C.气态氢化物的稳定性取决于元素非金属强弱,非金属性越强,气态氢化物稳定性越强;
D.同一周期元素,原子半径随着原子序数增大而减小,同一周期元素,离子半径先减小后增大再减小.
解答 解:A.元素的金属性越强,则最高价氧化物对应的水化物的碱性越强,第IA族碱金属元素随原子序数递增金属性递增,故A正确;
B.同一周期元素,元素的非金属性随着原子序数增大而增强,所以第ⅦA族元素是同周期中非金属性最强的元素,故B正确;
C.第ⅦA元素味卤族元素,从上到下非金属性减弱,气态氢化物稳定性依次减弱,故C正确;
D.同一周期元素,原子半径随着原子序数增大而减小,同一周期元素,离子半径先减小后增大再减小,故D错误;
故选D.
点评 本题考查结构性质位置关系、元素周期律等,题目难度中等,注意掌握同周期、同主族元素化合物性质的相似性越递变性.


科目:高中化学 来源: 题型:选择题
| A. | X 的能量一定高于 M | |
| B. | X 和 Y 的总能量一定高于 M 和 N 的总能量 | |
| C. | Y 的能量一定高于 N | |
| D. | 因为该反应是放热反应,故不必加热反应就一定能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH2-CH2Cl | B. | 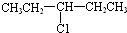 | ||
| C. | 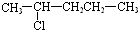 | D. | 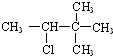 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下测得1molN2的质量为28g | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28mL | |
| C. | 用两只250mL的容量瓶配制0.1mol/L500mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5g胆矾,受热充分失水后,固体质量减轻1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 日常生活中铝制品具有一定的抗腐蚀性 | 铝常温下不能与氧气反应 |
| B | 用氢氟酸雕刻玻璃 | 氢氟酸能与玻璃中某些成分反应 |
| C | 用酒精进行消毒 | 酒精容易挥发 |
| D | 汽车尾气中含有氮的氧化物 | 汽油中含有氮元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com