
 将如图所示实验装置的K闭合,下列判断正确的是( )
将如图所示实验装置的K闭合,下列判断正确的是( )| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生还原反应 |
| C、片刻后甲池中c(SO42-)增大 |
| D、片刻后可观察到滤纸b点变红色 |


科目:高中化学 来源: 题型:
| A、标准状况下,1mol氦气含有2NA个原子 |
| B、在常温常压下,11.2L二氧化硫所含的分子数目为0.5NA |
| C、5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA |
| D、在常温常压下32g氧气所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
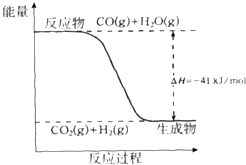 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ksp越小,则该物质在水中的溶解度肯定越小 |
| B、Ksp小的物质不可能转化为Ksp大的物质 |
| C、Ksp的大小只取决于物质属性,而与温度等其它因素无关 |
| D、易溶于水的物质也可能存在沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
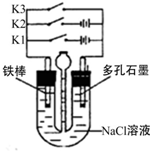
| A、只接通K3,一段时间后,漏斗液面上升 |
| B、只接通K1,一段时间后,U形管中出现白色沉淀 |
| C、只接通K2,U形管左、右两端液面均下降 |
| D、铁腐蚀的速度由大到小的顺序是:只接通K1>只接通K3>都断开>只接通K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | ||||
B、等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合:Ca2++2HC
| ||||
C、用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=C
| ||||
| D、将CO2通入次氯酸钙溶液可生成次氯酸:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com