
【题目】实验室需用2mol·L-1氯化钠溶液450 mL,配制时应选用容量瓶的规格和称取氯化钠的质量分别是
A.450 mL,52.7 gB.500 mL,58.5 g
C.450 mL,58.5 gD.500 mL,52.7 g
科目:高中化学 来源: 题型:
【题目】(1)如图所示,是原电池的装置图。请回答:
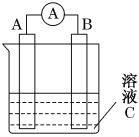
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;电子的移动方向是______________;反应进行一段时间后溶液C的氢离子浓度将________(填“升高”、“降低”或“基本不变”)。
(2)下图是一个双液原电池装置图,下列说法正确的是__________。
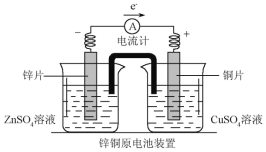
A.盐桥中的阴离子向CuSO4溶液中移动 B.盐桥的作用之一是平衡电荷
C.铜片作电池的负极 D.该电池比单液原电池的电流更稳定
(3)甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
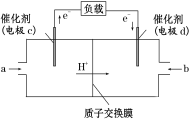
电池总反应为2CH3OH+3O2===2CO2+4H2O,则C电极是________(填“正极”或“负极”),C电极的反应方程式为_______________;若线路中转移3 mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,容积为5L的某密闭容器中将1mol A和2mol B发生如下反应:A(s)+2B(g) ![]() C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
A. 在5min内该反应用C的浓度变化表示的反应速率为0.02mol/(L·min)
B. 5min时,容器内D的浓度为0.2mol/L
C. 5min时容器内气体总的物质的量为3mol
D. 当容器内压强保持恒定时,该可逆反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作合理的是
A.用10mL量筒量取7.50mL稀盐酸
B.用25mL碱式滴定管量取14.80mLNaOH溶液
C.用广泛pH试纸测得某碱溶液的pH为12.7
D.用托盘天平称取25.20gNaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 用浓盐酸分别和KMnO4、KClO3反应制备l mol氯气,转移的电子数均为2NA
D. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g) +2B(s)![]() y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
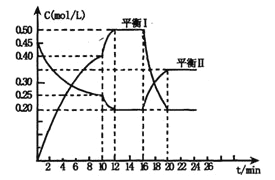
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=________;
(2)根据图示可确定x:y=_______________;
(3)0~l0min容器内压强_______________(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是____________;第16min引起曲线变化的反应条件可能是____________;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com