
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下正确的是( )
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、﹣2 | ﹣2 |
A.L2+与R2﹣的核外电子数相等 B.M与T形成的化合物既能与强酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R D.单质与浓度相等的稀盐酸反应的速率为Q>L
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:简答题
生活用水的净化、消毒杀菌处理与生产、生活废水的无害化处理与我们的生活密切相关,回答下列问题。
(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是___________水,除去水垢中CaSO4的试剂是纯碱、盐酸,写出除去CaSO4的离子反应方程式______________________、______________________。
(2)K2FeO4是一种新型的水处理剂,它兼有消毒杀菌、净水双重功能,具有消毒杀菌功能是因为它有___________性。但若水的酸性或碱性较强,该试剂的净水功能均会减弱甚至消失,原因是____________________________________________。
(3)右图是离子交换柱结构示意图,则左侧的是___________(填阴或阳)离子交换柱。硬度为1毅的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)的水。若某天然水中其它离子转化后相当于有c(Ca2+)=1.0×10-3mol/L,此水是否符合我国饮用水的硬度标准为___________(生活用水卫生标准规定,总硬度不超过450mg/L,写出计算式)。
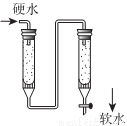
(4)用双硫腙(H2Dz)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Hg(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
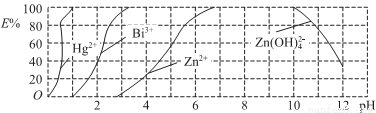
①当废水的pH=4时,废水中能以简单金属离子形式存在的离子是___________。
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,废水的pH=___________。
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:选择题
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为
2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。
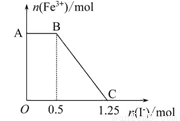
则下列有关说法不正确的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。 ②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请写出:
(1)A元素的最高价氧化物的结构式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证 明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
下列物质含有的化学键类型完全相同的是( )
A.NaBr和H2O B.Na2O和Na2O2 C.D2O和CO2 D.NH4Cl和HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期主族元素,原子半径依次减小。E元素与其它元素不在同一周期。C、D在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。A、B同周期,A2B是离子化合物。请回答:
(1)A2B的名称为 。C与E形成的具有10电子的4核分子的结构式为 。
(2)由上述五种元素中的某几种元素所形成的具有漂白作用的物质的化学式是:_______________(任意写一种)。
(3)B的最高价氧化物的水化物的浓溶液有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为 。
(4)由以上五种元素两两组合所形成的化合物中,有些物质能与水反应生成气体且属于氧化还原反应,请写出其中一个反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数),下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ⑨ | |||||
3 | ① | ③ | ⑤ | ⑩ | ||||
4 | ② | ④ | ⑧ |
(1)化学性质最不活泼的元素的原子结构示意图为_
(2)元素⑧的名称为_ ,其最高价氧化物的水化物的化学式为_
(3)用电子式表示元素②与元素⑨形成化合物的过程_
(4)非金属性最强的元素是_ (填元素符号);除0族外原子半径最大的元素是_ (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是_
(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为 (用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH—离子重新组合,生成新的物质,写出该反应的化学方程式_
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
某羧酸酯的分子式为C18H26O5,1mo该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子子式为( )
A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com