
A.电负性Cl>F>Se,原子半径Se>Cl>F B.电负性F>Cl>Se,原子半径F>Cl>Se
C.电负性F>Cl>Se,原子半径Se>Cl>F D.电负性Se>Cl>F,原子半径Se>Cl>F
科目:高中化学 来源: 题型:
 卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg、Al三种元素的原子半径依次减小 | B、N、0、F三种元素的非金属性依次减弱 | C、F、Cl、Br三种原子的核外电子层数依次增多 | D、P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省枣庄市高三3月模拟考试理综化学试卷(解析版) 题型:计算题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为________,NF3分子的空间构型为________。
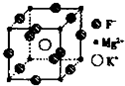
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
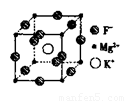
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高一下期末考试文科化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.N、O、F三种元素的非金属性依次减弱
B.Na、Mg、Al三种元素的原子半径依次减小
C.F、Cl、Br三种原子的核外电子层数依次增多
D.P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com