
分析 (1)惰性气体分子为单原子分子不存在化学键;
(2)同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;
(3)原子晶体是共价键结合成空间网状结构,所以受热熔化后,需克服共价键;
(4)过氧化氢是含有非极性键构成共价化合物;
(5)⑥NaOH ⑦Na2O2 ⑧NH4Cl三种物质中既存在离子键又存在共价键;
(6)①Ne ②HCl ③P4 ④H2O2 四种物质都是分子晶体.
解答 解:(1):①Ne是单原子分子无化学键,故答案为:①;
(2)H2O2分子中既存在非极性共价键氧氧键又存在极性共价键氧氢键,故答案为:④;
(3)原子晶体是共价键结合成空间网状结构,所以受热熔化后,需克服共价键,故答案为:⑤;
(4)过氧化氢是含有非极性键构成共价化合物,故答案为:④;
(5)⑥NaOH ⑦Na2O2 ⑧NH4Cl三种物质中既存在离子键又存在共价键,所以既存在离子键又存在共价键的是⑥⑦⑧,故答案为:⑥⑦⑧;
(6)①Ne ②HCl ③P4 ④H2O2 四种物质都是分子晶体,所以分子晶体的是:①②③④,故答案为:①②③④.
点评 本题考查化学键,明确元素的类别及元素的成键是解答本题 的关键,难度较小.


科目:高中化学 来源: 题型:填空题
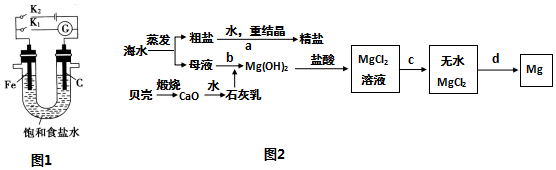
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
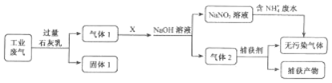
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
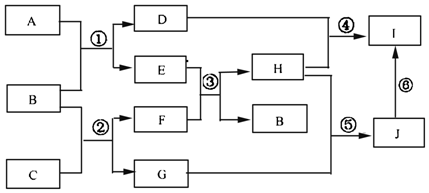
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
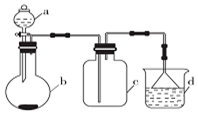 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
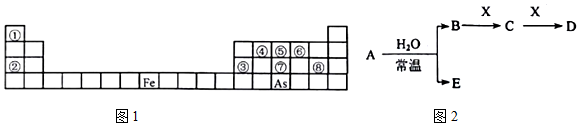
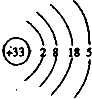 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com