
【题目】产自我国西北某盐湖的“块碱”是一种Na2CO3和NaCl的混合物。可通过以下方法对块碱样品的组成和含量进行分析测定。
I.定性测定NaCl的存在:
(1)取样品少许溶于水,加入足量稀硝酸充分反应后再滴加______溶液,能观察到有______________产生,说明块碱中含有NaCl。
II.定量测定Na2CO3的含量:准确称量w g样品置于如图所示的装置中,向其中加入足量稀硫酸,通过测定生成气体的体积来求算Na2CO3的含量。请回答下列相关问题:
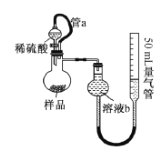
(2)测定装置中,导管a的作用是__________________。
(3)为提高测定的准确度,溶液b最宜选用__________________。
①饱和食盐水 ②饱和NaHCO3溶液 ③澄清石灰水 ④酸性KMnO4溶液
(4)以下是测量收集到气体体积必须包括的几个步骤:①调整橡胶管所连两装置液面高度使之相同;②使装置内的气体都冷却至室温;③读取碱式滴定管的示数。这三步操作的正确顺序是:________(请填写步骤代号)。
【答案】AgNO3 白色沉淀 平衡压强,让液体顺利流下、消除稀硫酸体积产生的误差 ② ②①③
【解析】
(1)因碳酸根离子会干扰氯离子检验,检验块碱中存在氯化钠时,应排除碳酸钠对检验的干扰;
(2)测定装置中,导管a将分液漏斗和圆底烧瓶连通,能起到平衡气压的作用;
(3)二氧化碳溶于水,溶液中碳酸氢根能使碳酸电离平衡左移,抑制二氧化碳的溶解;
(4)测定二氧化碳气体体积时,应注意反应前后应为同温同压的条件。
(1)因碳酸根离子会干扰氯离子检验,检验块碱中存在氯化钠时,应排除碳酸钠对检验的干扰,具体操作为取样品少许溶于水,加入足量稀硝酸充分反应后再滴加硝酸银溶液,有白色沉淀生成,说明块碱中含有NaCl,故答案为:AgNO3;白色沉淀;
(2)测定装置中,导管a将分液漏斗和圆底烧瓶连通,能起到平衡气压,便于稀硫酸顺利流下的作用,还可以起到防止稀硫酸体积导致产生测定误差,故答案为:平衡压强,让液体顺利流下、消除稀硫酸体积产生的误差;
(3)二氧化碳溶于水,溶液中碳酸氢根能使碳酸电离平衡左移,抑制二氧化碳的溶解,为防止溶解造成误差,测定二氧化碳气体体积时,溶液b应选用饱和碳酸氢钠溶液,提高测定的准确度,故答案为:②;
(4)测定二氧化碳气体体积时,应注意反应前后应为同温同压的条件,则测定步骤为先使装置内的气体都冷却至室温达到同温的目的,再调整橡胶管所连两装置液面高度使之相同达到同压的目的,最后读取碱式滴定管的示数,记录数据,故答案为:②①③。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.40gNaOH溶于水所得1L溶液的浓度为1mol·L-1
B.1mol·L-1的Na2CO3溶液中Na+的浓度为1mol·L-1
C.从1L0.1mol·L-1的NaCl溶液中取出0.1L溶液,则NaCl的浓度变为0.01 mol·L-1
D.1L0.2 mol·L-1的Na2SO4溶液中,Na+的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。下列有关P4S3的说法中不正确的是( )
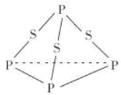
A.P4S3中各原子最外层均满足 8 电子稳定结构
B.P4S3中磷元素为+ 3 价
C.P4S3中 P 原子和 S 原子均为 sp3杂化
D.1molP4S3分子中含有 6mol 极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
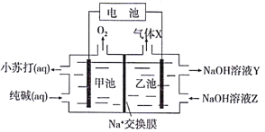
上述装置工作时,下列有关说法正确的是( )
A. 乙池电极接电池正极,气体X为H2
B. Na+由乙池穿过交换膜进入甲池
C. NaOH溶液Z比NaOH溶液Y浓度小
D. 甲池电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
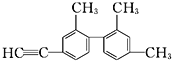
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com