
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴离子具有氧化性 | B.溴离子的还原性比氯离子弱 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将明矾加入海水中静置过滤是海水淡化的方法之一 |
| B.海水晒盐的过程发生复分解反应 |
| C.海水中提取镁的过程不涉及氧化还原反应 |
| D.从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
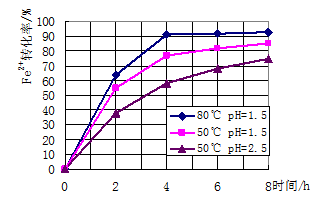
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
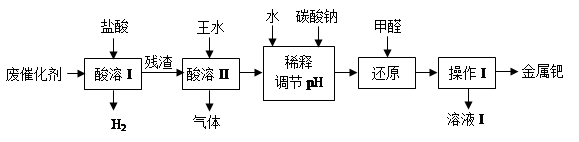
 3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.①③ | C.①②③ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com