
| A. | CO的燃烧热为 283 kJ | |
| B. | 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol | |
| C. | 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023 |
分析 A.燃烧热的单位应该为kJ/mol;
B.焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能;
C.固态二氧化碳具有的能量较小,则反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)放出热量减小,结合焓变为负值分析;
D.依据热化学方程式,结合盖斯定律计算得到热化学方程式计算分析.
解答 解:A.根据反应①可知CO的燃烧热为 283 kJ/mol,故A错误;
B.反应①的△H=-566kJ/mol,则正反应的活化能-逆反应的活化能=-566kJ•mol-1,反应①正反应活化能与逆反应活化能之差为-566 kJ/mol,故B错误;
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)中二氧化碳为固态,则该反应比反应②放出热量减小,由于焓变为负值,则该反应的△H>-452 kJ/mol,故C正确;
D.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
依据盖斯定律②×2+①得:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ/mol;
CO(g)与Na2O2(s)反应放出509 kJ热量时,反应消耗一氧化碳物质的量为:$\frac{509kJ}{1018kJ/mol}$×2=1mol,1molCO被氧化成二氧化碳转移了2mol电子,电子转移数为2×6.02×1023,故D错误;
故选C.
点评 本题考查较为综合,涉及反应热与焓变的应用、氧化还原反应的计算、盖斯定律的应用等知识,明确化学反应与能量变化的关系为解答关键,注意掌握盖斯定律的内容、氧化还原反应中电子守恒的应用方法,试题知识点较多,充分考查了学生的灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
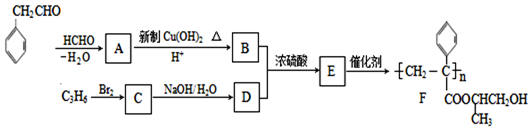
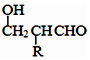 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$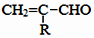
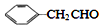 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比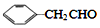 大14的,则符合下列条件的G的同分异构体有9种.
大14的,则符合下列条件的G的同分异构体有9种.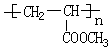 的合成路线
的合成路线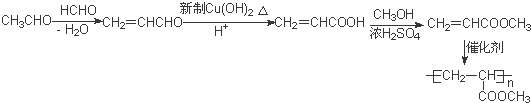 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应Al-3e-=Al3+ | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 海水中的 OH ? 向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
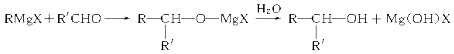
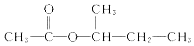 )的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.
)的流程如下(部分反应物及反应条件没有列出),A主要来源于石油裂解气,A的产量常作为衡量石油化工水平的标志.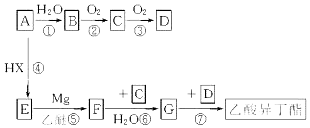
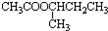 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ≡O$\stackrel{HCN}{→}$
≡O$\stackrel{HCN}{→}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
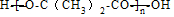 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带 正电 |
| B | 将铜粉加入 1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活 泼 |
| C | 用坩埚钳夹住用砂纸 仔细打磨过的铝箔在 酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比 较低 |
| D | 向盛有少量浓硝酸、 稀硝酸的两支试管中 分别加入一片大小相 同的铜片 | 浓硝酸中铜片很快开始溶解,并放出 红棕色气体;稀硝酸中过一会铜片表 面才出现无色气体,气体遇空气变红 棕色 | 浓硝酸氧化性强 于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com