


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、有丁达尔效应 |
| B、浑浊不透明 |
| C、不能透过滤纸 |
| D、所得分散系不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:向盛有固体K2Cr2O7的A、B两试管中分别加入一定量的稀硫酸 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
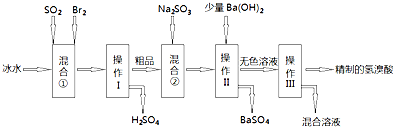
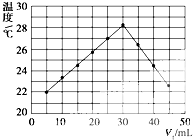 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
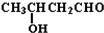
| -H2O |
| △ |
 +CO
+CO| AlCl3,HCl |
| △ |
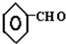
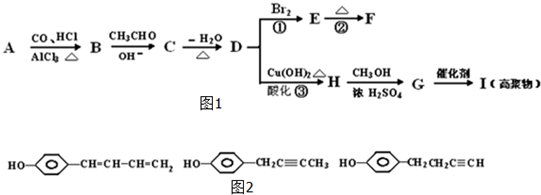
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com