
【题目】有机物F( )为一种高分子树脂,物质C的分子式为:C10H10Obr2;F的合成路线如下:
)为一种高分子树脂,物质C的分子式为:C10H10Obr2;F的合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_____________________________________。
(2)E生成F的反应类型为___________________________________。
(3)D的结构简式为________________________________。
(4)由B生成C的化学方程式为______________________________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢谱显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式____________、________________________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料-聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):__________________________。
)的合成路线(无机试剂自选):__________________________。
【答案】 甲醛 缩聚反应 ![]()
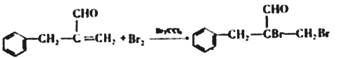
【解析】根据信息:A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;A苯丙醛,根据F(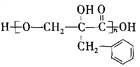 的结构简式可知,E为含有羟基的芳香羧酸,根据C的分子式和生成D和E条件可知,C→D为羟基或醛基的氧化,D→E为卤素原子的水解反应,结合E的结构可知,D为含有溴原子的芳香羧酸,则C为含有溴原子的芳香醛,B为含有碳碳双键的芳香醛,根据信息②可知X为甲醛。
的结构简式可知,E为含有羟基的芳香羧酸,根据C的分子式和生成D和E条件可知,C→D为羟基或醛基的氧化,D→E为卤素原子的水解反应,结合E的结构可知,D为含有溴原子的芳香羧酸,则C为含有溴原子的芳香醛,B为含有碳碳双键的芳香醛,根据信息②可知X为甲醛。
(1)由上述分析, X为甲醛,正确答案:甲醛。
(2)根据F( )结构可知,该物质是由羟基和羧基发生缩聚反应生成的,因此该反应类型为缩聚反应;正确答案:缩聚反应。
)结构可知,该物质是由羟基和羧基发生缩聚反应生成的,因此该反应类型为缩聚反应;正确答案:缩聚反应。
(3)根据C的分子式和生成D和E条件可知,C→D为羟基或醛基的氧化,D→E为卤素原子的水解反应,结合E的结构可知,D为含有溴原子的芳香羧酸,D的结构简式为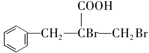 ;正确答案:
;正确答案: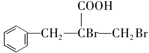 。
。
(4)由题分析可知B为含有碳碳双键的芳香醛,可以与溴发生加成反应,化学方程式为: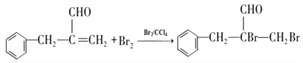 ;正确答案:
;正确答案: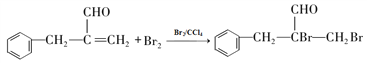 。
。
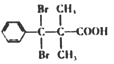
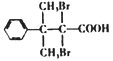
(5)D的结构简式为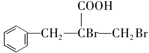 ,芳香族化合物Y是D的同系物,说明均含有羧基和溴原子,能够与饱和Na2CO3溶液反应放出气体,说明含有羧基,分子中只有1个侧链,结构的变化只是碳链异构和溴原子位置异构,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1,说明苯环上有3种氢原子,个数比为2:2:1,侧链含有2种氢原子,个数比为6:1,符合要求的Y的结构简式为
,芳香族化合物Y是D的同系物,说明均含有羧基和溴原子,能够与饱和Na2CO3溶液反应放出气体,说明含有羧基,分子中只有1个侧链,结构的变化只是碳链异构和溴原子位置异构,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1,说明苯环上有3种氢原子,个数比为2:2:1,侧链含有2种氢原子,个数比为6:1,符合要求的Y的结构简式为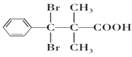 、
、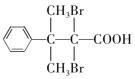 ;正确答案:
;正确答案: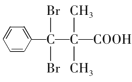 、
、 。
。
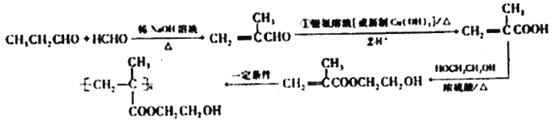
(6)要合成有机物 ,就得先合成CH2=C(CH3)COOCH2CH2OH,若要合成CH2=C(CH3)COOCH2CH2OH,就得用甲基丙烯酸与乙二醇发生酯化反应,而甲基丙烯酸就得由甲基丙烯醛氧化得来,而丙醛和甲醛在碱性环境下反应生成甲基丙烯醛。因此制备该物质的流程如下:
,就得先合成CH2=C(CH3)COOCH2CH2OH,若要合成CH2=C(CH3)COOCH2CH2OH,就得用甲基丙烯酸与乙二醇发生酯化反应,而甲基丙烯酸就得由甲基丙烯醛氧化得来,而丙醛和甲醛在碱性环境下反应生成甲基丙烯醛。因此制备该物质的流程如下:
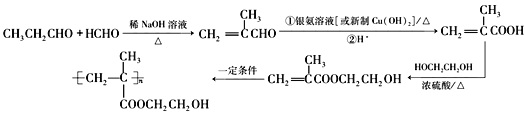 ;正确答案:
;正确答案:


科目:高中化学 来源: 题型:
【题目】硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g)![]() C2H5OH+3H2O(g) △H=-173.6kJ/mol
C2H5OH+3H2O(g) △H=-173.6kJ/mol
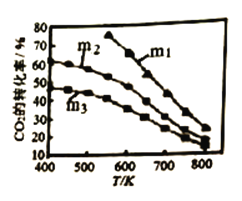
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=![]() ,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。
,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS水解的化学方程式为_________________。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83kJ热量。该脱硫反应的热化学方程式为_________________。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________,该反应的阳极材料是______。
④常温下,HCl和CuCl2的混合溶液中,c(H+)=0.30mol/L,c(Cu2+)=0.10mol/L,往该溶液中通入H2S至饱和(H2S的近似浓度为0.10mol/L),_____(填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-5,Ksp(CuS)=1.4×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2,在相同温度下再达到平衡时PCl5的物质的量是
A. 0.8mol B. 0.4mol C. 小于0.4mol D. 大于0.4mol,小于0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如下实验装置。请回答下列问题:
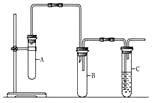
(1)将导气管末端插入盛水的C试管中,用酒精灯加热(或用手捂)装置A中大试管,若__________现象,且移开酒精灯(或松开手)一会儿,导气管中出现________,则证明装置气密性良好。
(2)向装置A中先加入1,2二氯乙烷和NaOH的乙醇溶液,再加碎瓷片,碎瓷片的作用是__。
(3)为了使反应在75℃左右进行,常用的加热方法是________________,其优点是__________。
(4)与装置A中大试管相连接的长玻璃管的作用是____________,装置B的作用是______。
(5)为证明1,2-二氯乙烷已发生消去反应,则C中应装____________,现象是_______________,装置A中发生反应的化学方程式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2的化学键类型_______________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________。
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_____________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04mol的电子,有____g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.1000mol/L的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL。则该样品中Na2S2O4的质量分数为________(杂质不参与反应)。(保留至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
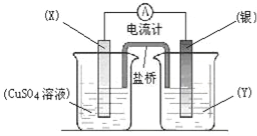
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3种分子中含有相同数目的质子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:

下列说法正确的是( )
A. C与A形成的常见化合物是同主族元素同类型化合物中沸点最低的
B. B是元素周期表中原子半径最小的元素
C. D的最高价氧化物的水化物一定是一种强酸
D. C的单质可以与D的氢化物发生置换反应生成D的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向苯酚浊液中滴加Na2CO3溶液:2C6H5OH+CO32-=2C6H5O-+H2O+CO2↑
C. 向偏铝酸钠溶液中加入NaHCO3溶液: AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. 碳酸氢铵溶液中加入足量NaOH溶液共热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com