
”¾ĢāÄæ”æCOŗĶNO¶¼ŹĒĘū³µĪ²ĘųÖŠµÄÓŠŗ¦ĪļÖŹ£¬ĖüĆĒÖ®¼äÄÜ»ŗĀżµŲ·¢ÉśČēĻĀ·“Ó¦£ŗ2NO(g)£«2CO(g) ![]() N2(g)£«2CO2(g)””¦¤H<0£¬ĻÖĄūÓĆ“Ė·“Ó¦£¬ÄāÉč¼ĘŅ»ÖÖ»·±£×°ÖĆ£¬ÓĆĄ“Ļū³żĘū³µĪ²Ęų¶Ō“óĘųµÄĪŪČ¾£¬ĻĀĮŠÉč¼Ę·½°øæÉŅŌ×īÓŠŠ§µÄĢįøßĪ²Ęų“¦ĄķŠ§¹ūµÄŹĒ (””””)
N2(g)£«2CO2(g)””¦¤H<0£¬ĻÖĄūÓĆ“Ė·“Ó¦£¬ÄāÉč¼ĘŅ»ÖÖ»·±£×°ÖĆ£¬ÓĆĄ“Ļū³żĘū³µĪ²Ęų¶Ō“óĘųµÄĪŪČ¾£¬ĻĀĮŠÉč¼Ę·½°øæÉŅŌ×īÓŠŠ§µÄĢįøßĪ²Ęų“¦ĄķŠ§¹ūµÄŹĒ (””””)
¢ŁŃ”ÓĆŹŹµ±µÄ“߻ƼĮ”” ¢ŚĢįøß×°ÖĆĪĀ¶Č”” ¢Ū½µµĶ×°ÖƵÄŃ¹Ēæ”” ¢Ü×°ÖĆÖŠ·ÅČė¼īŹÆ»Ņ
A. ¢Ł¢Ü B. ¢Ś¢Ü C. ¢Ł D. ¢Ś¢Ū
”¾“š°ø”æA
”¾½āĪö”æŅŖĢįøßĪ²Ęų“¦ĄķŠ§¹ū,ŠčŅŖĪ²ĘųÅŷŵ½“óĘųÖ®Ē°¾”æÉÄܵÄ×Ŗ»ÆĪŖĪŽŗ¦ĘųĢå,Ó¦“ÓĖŁĀŹ¼°Ę½ŗāµÄ½Ē¶Č·ÖĪö: ¢Ł“߻ƼĮ,æÉŅŌ¼Óæģ·“Ó¦ĖŁĀŹ,µ«²»Ó°Ļģ×Ŗ»ÆĀŹ£»ĢįøßĪĀ¶Č,ÄܼÓæģ·“Ó¦ĖŁĀŹ,µ«»į½µµĶ×Ŗ»ÆĀŹ£»¢Ū½µµĶŃ¹Ēæ,¼Č¼õĀż·“Ó¦ĖŁĀŹ,ÓÖ½µµĶ×Ŗ»ÆĀŹ£»¢Ü·ÅČė¼īŹÆ»Ņ,æÉŅŌĪüŹÕÉś³ÉµÄ¶žŃõ»ÆĢ¼,Ź¹Ę½ŗāĻņÓŅŅĘ¶Æ”£
¢ŁŃ”ÓĆŹŹµ±µÄ“߻ƼĮ,æÉŅŌ¼Óæģ·“Ó¦ĖŁĀŹ,µ«²»Ó°Ļģ×Ŗ»ÆĀŹ,Ź¹ÓŠŗ¦ĘųĢåŌŚÅųöÖ®Ē°¾”æÉÄܵŲ×Ŗ»ÆĪŖĪŽŗ¦ĘųĢå,æÉŅŌĢįøßĪ²Ęų“¦ĄķŠ§¹ū£¬ÕżČ·£»¢ŚĢįøß×°ÖĆĪĀ¶Č,ĖäČ»ÄܼÓæģ·“Ó¦ĖŁĀŹ,øĆ·“Ó¦·ÅČČ£¬Ę½ŗā×óŅĘ£¬µ«»į½µµĶ×Ŗ»ÆĀŹ,“ķĪ󣻢Ū½µµĶ×°ÖƵÄŃ¹Ēæ,¼Č¼õĀż·“Ó¦ĖŁĀŹ,ÓÖ½µµĶ×Ŗ»ÆĀŹ£¬“ķĪ󣻢Ü×°ÖĆÖŠ·ÅČė¼īŹÆ»Ņ,æÉŅŌĪüŹÕÉś³ÉµÄ¶žŃõ»ÆĢ¼,Ź¹Ę½ŗāĻņÓŅŅʶÆ,Ģįøß×Ŗ»ÆĀŹ£¬ÕżČ·£»·ūŗĻĢāŅāĪŖ¢Ł¢Ü£»ÕżČ·Ń”ĻīA”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
A.ŗĻ³Éøß·Ö×Ó²ÄĮĻ°üĄØĖÜĮĻ”¢ŗĻ³ÉĻĖĪ¬”¢ŗĻ³ÉĻš½ŗ”¢š¤ŗĻ¼Į”¢ĶæĮĻµČ
B.ÓĆľ²ÄµČ¾¹ż¼Ó¹¤ÖĘ³ÉµÄš¤½ŗĻĖĪ¬ŹōÓŚŗĻ³ÉĻĖĪ¬
C.ĆŽ»Ø”¢ŃņĆ«ŗĶĢģČ»Ļš½ŗŹĒÓŠ»śøß·Ö×Ó²ÄĮĻ
D.ŗĻ³ÉĻš½ŗµÄŌĮĻŹĒĆŗ”¢ŹÆÓĶ”¢ĢģČ»ĘųŗĶÅ©ø±²śĘ·
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ĢĢåµā»Æļ§ÖĆÓŚĆܱÕČŻĘ÷ÖŠ£¬¼ÓČČÖĮŅ»¶ØĪĀ¶ČŗóŗćĪĀ£»ČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ¢ŁNH4I£Øs£©![]() NH3£Øg£©+HI£Øg£©¢Ś2HI£Øg£©
NH3£Øg£©+HI£Øg£©¢Ś2HI£Øg£©![]() H2£Øg£©+I2£Øg£©£¬²āµĆĘ½ŗāŹ±c£ØH2£©=0.5mol/L£¬·“Ó¦¢ŁµÄĘ½ŗā³£ŹżĪŖ20£¬ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒ £Ø £©
H2£Øg£©+I2£Øg£©£¬²āµĆĘ½ŗāŹ±c£ØH2£©=0.5mol/L£¬·“Ó¦¢ŁµÄĘ½ŗā³£ŹżĪŖ20£¬ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒ £Ø £©
A. Ę½ŗāŹ±HI·Ö½āĀŹĪŖ20%
B. µ±¹ĢĢåµā»Æļ§ĪļÖŹµÄĮæŌö“óŅ»±¶£¬ŌņŌŚĻąĶ¬Ģõ¼žĻĀ£¬ČŻĘ÷ÄŚŃ¹Ēæ±ä“ó
C. ¹ĢĢåµā»Æļ§Ņ»¶ØĶźČ«·Ö½ā
D. Ę½ŗāŹ±C£ØHI£©=5mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCl2ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŌĮĻ£¬ŅŗĀČ“¢“ęĒųĢłÓŠµÄĖµĆ÷æØČēĻĀ£ŗ
°ü×° | øÖĘæ |
“¢ŌĖŅŖĒó | Ō¶Ąė½šŹō·ŪÄ©”¢°±”¢ĢžĄą”¢“¼ĄąĪļÖŹ£»ÉčÖĆĀČĘų¼ģ²āŅĒ |
Š¹Ā©“¦Ąķ | NaOH”¢NaHSO3ČÜŅŗĪüŹÕ |
ĻĀĮŠ½āŹĶŹĀŹµµÄ·½³ĢŹ½²»ÕżČ·µÄŹĒ
A. µē½ā±„ŗĶŹ³ŃĪĖ®ÖĘČ”Cl2£ŗ2Cl£ +2H2O![]() 2OH£+ H2”ü+Cl2”ü
2OH£+ H2”ü+Cl2”ü
B. ĀČĘųÓĆÓŚ×ŌĄ“Ė®Ļū¶¾£ŗCl2 + H2O![]() 2H+ + Cl£+ ClO£
2H+ + Cl£+ ClO£
C. ÅØ°±Ė®¼ģŃ銹Ā¶µÄĀČĘų£¬²śÉś°×ŃĢ£ŗ8NH3 + 3Cl2 === 6 NH4Cl + N2
D. ĀČĘų”°Š¹Ā©“¦Ąķ”±ÖŠNaHSO3ČÜŅŗµÄ×÷ÓĆ£ŗHSO3£+ Cl2 + H2O === SO42£+ 3H+ + 2Cl£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ»Æѧ·“Ó¦ÓėÄÜĮæ±ä»ÆµÄĖµ·ØÕżČ·µÄŹĒ
A. Č¼ÉÕŹōÓŚ·ÅČČ·“Ó¦
B. ÖŠŗĶ·“Ó¦ŹĒĪüČČ·“Ó¦
C. ¶ĻĮŃ»Æѧ¼ü·Å³öÄÜĮæ
D. ·“Ó¦Īļ×ÜÄÜĮæÓėÉś³ÉĪļ×ÜÄÜĮæŅ»¶ØĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĀś×ć²»Ķ¬µÄŠčŅŖ£¬ČĖĆĒÓ¦ÓĆŌµē³ŲŌĄķÖĘ×÷ĮĖ¶ąÖÖµē³Ų”£
£Ø1£©ÓŠČĖŅŌ»Æѧ·“Ó¦2Zn+O2+4H+=2Zn2++2H2OĪŖ»ł“”Éč¼ĘŅ»ÖÖŌµē³Ų£¬ŅĘČėČĖĢåÄŚ×÷ĪŖŠÄŌąĘš²«Ę÷µÄÄÜŌ“£¬ĖüĆĒææČĖĢåÄŚŃŖŅŗÖŠČÜÓŠŅ»¶ØÅØ¶ČµÄO2”¢H+”¢Zn2+½ųŠŠ¹¤×÷£¬ŌņøĆŌµē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ___________”£
£Ø2£©FeCl3ČÜŅŗ³£ÓĆÓŚøÆŹ“Ó”Ė¢µēĀ·Ķ°å£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________£»Čō½«“Ė·“Ó¦Éč¼Ę»ņŌµē³Ų£¬Ōņøŗ¼«ĖłÓƵē¼«²ÄĮĻĪŖ___________£¬Õż¼«·“Ó¦ĪŖ_________________”£
£Ø3£©ĆĄ¹ś°¢²ØĀŽÓīÖę·É“¬ÉĻŹ¹ÓĆĮĖŅ»ÖÖŠĀŠĶ·¢µē×°ÖĆ”ŖĒāŃõČ¼ĮĻµē³Ų£¬Ęä¹¹ŌģČēĶ¼ĖłŹ¾£¬ĘäÖŠA”¢BĮ½øöµē¼«¾łÓɶąæ×µÄĢ¼Č²×é³É£¬øƵē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ_________________£¬ČōøƵē³Ų¹¤×÷Ź±ČÜŅŗÖŠŌö¼Ó1molH2O£¬ŌņĄķĀŪÉĻµēĀ·ÖŠĶعżµē×ÓµÄĪļÖŹµÄĮæĪŖ_______________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éĢ½¾æĢśŗĶĻõĖįŅųČÜŅŗµÄ·“Ó¦£¬ŹµŃé¹ż³ĢČēĻĀ£ŗ
ŹµŃéŠņŗÅ | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
I | ½«Ņ»Źų¹āĮĮ½ą¾»µÄĢśĖæÉģČėµ½0.1mol/L µÄAgNO3ČÜŅŗÖŠ | ĢśĖæ±ķĆęÓŠŅų°×É«¹ĢĢåĪö³ö£¬ČÜŅŗÖš½„±äĪŖĒ³ĀĢÉ« |
II | ȔɣĮæŹµŃéIÖŠÉĻ²ćĒåŅŗ£¬µĪČėK3[Fe(CN) 6]ČÜŅŗ | ÓŠĄ¶É«³ĮµķÉś³É |
£Ø1£©øł¾ŻÉĻŹöŹµŃéĻÖĻ󣬼×Ķ¬Ń§ČĻĪŖÓŠFe2+Éś³É£¬ĢśŗĶĻõĖįŅųČÜŅŗµÄ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________________”£
£Ø2£©ŅŅĶ¬Ń§ČĻĪŖŹµŃéÖŠæÉÄÜÉś³ÉFe3+£¬Éč¼Ę²¢Ķź³ÉČēĻĀŹµŃé
ŹµŃéŠņŗÅ | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
III | ȔɣĮæŹµŃéIÖŠÉĻ²ćĒåŅŗ£¬µĪČėÉŁĮæKSCNČÜŅŗ£¬Õńµ“ | ²śÉś°×É«³Įµķ£¬ČÜŅŗ¾Ö²æ±äŗģ£¬Õńµ“ŗóŗģÉ«ĻūŹ§£¬³ĮµķĮæŌö¼Ó |
²éŌÄ׏ĮĻ£ŗAg+ÓėSCN£Éś³É°×É«³ĮµķAgSCN
ŅŅĶ¬Ń§ÅŠ¶ĻÓŠFe3+£¬ĄķÓÉŹĒ ____________________”£
£Ø3£©ŅŅĶ¬Ń§¼ĢŠųĢ½¾æŗģÉ«ĶŹČ„µÄŌŅņ£¬Éč¼Ę²¢Ķź³ÉČēĻĀŹµŃé
ŹµŃéŠņŗÅ | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
IV | ȔɣĮæŹµŃéIÖŠÉĻ²ćĒåŅŗ£¬µĪ¼Ó¼øµĪĻ”ŃĪĖį | ÓŠ°×É«³ĮµķÉś³É |
V | Č”1mLFe(NO3)3ČÜŅŗ£¬µĪ¼Ó2µĪµČÅØ¶ČµÄKSCNČÜŅŗ£¬Õńµ“£¬ŌŁµĪ¼ÓÉŁĮæAgNO3ČÜŅŗ | ČÜŅŗ±äŗģ£»Õńµ“ČÜŅŗŃÕÉ«ĪŽ±ä»Æ£¬µĪ¼ÓAgNO3ŗóČÜŅŗŗģÉ«ĶŹČ„£¬²śÉś°×É«³Įµķ£® |
¢Ł ŹµŃéIVµÄÄæµÄŹĒ____________________£»
¢Ś ÓĆĘ½ŗāŅʶÆŌĄķ½āŹĶ£¬ŹµŃéVÖŠČÜŅŗŗģÉ«ĶŹČ„µÄŌŅņ____________________”£
£Ø4£©±ūČĻĪŖČÜŅŗÖŠFe3+ŹĒFe2+±»Ag+Ńõ»ÆĖłÖĀ”£°“ĻĀĶ¼Į¬½Ó×°ÖĆ²¢½ųŠŠŹµŃ飬Ņ»¶ĪŹ±¼äŗóČ”³ö×ó²ąÉÕ±ČÜŅŗ¼ÓČėKSCNČÜŅŗ£¬ČÜŅŗ±äŗģ
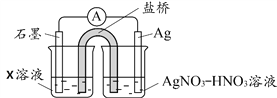
¢Ł ĘäÖŠXČÜŅŗŹĒ____________________£»
¢Ś ÓÉŹµŃéµĆ³öAg+ŗĶFe2+·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________________£»
¢Ū ±ūĶ¬Ń§µÄŹµŃéÉč¼Ę¼°½įĀŪŹĒ·ńŗĻĄķ£¬ĒėĖµĆ÷ĄķÓÉ____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖ»łÓŚĖįŠŌČ¼ĮĻµē³ŲŌĄķÉč¼ĘµÄ¾Ę¾«¼ģ²āŅĒ£¬øŗ¼«ÉĻµÄ·“Ó¦ĪŖ£ŗCH3CH2OH©4e©+H2O=CH3COOH+4H+ £® ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
A.Õż¼«ÉĻ·¢ÉśµÄ·“Ó¦ĪŖ£ŗO2+2H2O+4e©=4OH©
B.µē³Ų·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCH3CH2OH+O2=CH3COOH+H2O
C.¼ģ²āŹ±£¬ČÜŅŗÖŠµÄH+Ļņøŗ¼«ŅʶÆ
D.ČōÓŠ0.4molµē×Ó×ŖŅĘ£¬ŌņŌŚ±ź×¼×“æöĻĀĻūŗÄ4.48LŃõĘų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬pH=l µÄijČÜŅŗ A ÖŠ³żH+Ķā£¬»¹ŗ¬ÓŠNH4+”¢K+”¢Na+”¢Fe3+”¢Al3+”¢Fe2+”¢CO32-”¢NO3-”¢ Cl-”¢I-”¢SO42-ÖŠµÄ4ÖÖ£¬ĒŅČÜŅŗÖŠø÷Ąė×ÓµÄĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1mol”¤L-1”£ĻÖČ”øĆČÜŅŗ½ųŠŠÓŠ¹ŲŹµŃ飬ŹµŃé½į¹ūČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ

A. øĆČÜŅŗÖŠŅ»¶ØÓŠÉĻŹöĄė×ÓÖŠµÄNO3-”¢Al3+”¢SO42-”¢Cl-ĖÄÖÖĄė×Ó
B. ŹµĪļĻūŗÄCu14.4g£¬ŌņÉś³ÉĘųĢ嶔µÄĢå»żĪŖ3.36L
C. øĆČÜŅŗŅ»¶ØƻӊFe3+£¬µ«ŹĒĪŽ·ØČ·¶ØŹĒ·ńŗ¬ÓŠI-
D. ³ĮµķŅŅŅ»¶ØÓŠBaCO3£¬æÉÄÜÓŠBaSO4
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com