
 .
.分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最小的元素,则D为Al元素;E元素的原子最外层比次外层少两个电子,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Al小,则C为O元素,据此答题.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最小的元素,则D为Al元素;E元素的原子最外层比次外层少两个电子,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Al小,则C为O元素,
(1)C为O元素,C的离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)F是Cl元素,F元素位于周期表中第三周期第ⅤⅡA族、第17纵行,故答案为:三;ⅤⅡA;17;
(3)元素的非金属性越强,气态氢化物越稳定,非金属性O>N>S,所以B、C、E分别与A形成的化合物中最稳定的是H2O,故答案为:H2O;
(4)B的气态氢化物为氨气,在催化剂存在下跟氧气反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)氯气在反应中常作氧化剂,氯气的水溶液与E的低价氧化物即二氧化硫反应的离子方程式为SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:氧化;SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(6)由上述六种元素所形成的10电子微粒的化学式为N3-、O2-、Al3+、H2O、NH3、OH-、NH4+、H3O+、NH2-,
故答案为:N3-、O2-、Al3+、H2O、NH3、OH-、NH4+、H3O+、NH2-(任选5种).
点评 本题主要考查了原子结构示意图、元素周期表、离子反应、氧化还原反应、10电子微粒等知识点,难度不大,解题的关键在于抓住X的水溶液呈碱性为突破口,进行元素推断.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-10 mol/L | B. | 2.2×10-12 mol/L | C. | 2.2×10-14 mol/L | D. | 1.1×10-21 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | B. | Mg2+ N${H}_{4}^{+}$ S${O}_{4}^{2-}$ Cl- | ||
| C. | Na+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | D. | Ba2+ Na+ Mn${O}_{4}^{-}$ S${O}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
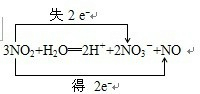 .
.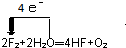 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族.
A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏时把温度计插入液面以下 | B. | 可用裂化汽油萃取溴水中的溴 | ||
| C. | 将乙醇加入银氨溶液中加热制银镜 | D. | 将苯和液溴混合后加入Fe粉制溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子从发生还原反应的电极流出 | |
| B. | 原电池的两极一定是由活泼性不同的两种金属组成 | |
| C. | 燃料电池的转化率为100% | |
| D. | 原电池中的反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com