
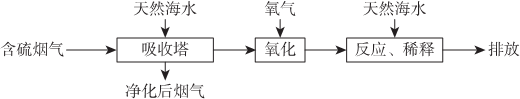
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
分析 A.根据海水中的离子是否水解进行解答;
B.根据使用空气中的氧气将H2SO3氧化来分析;
C.利用酸碱反应分析混合的目的;
D.“排放”出来的海水体积与进入吸收塔的天然海水的体积不同.
解答 解:A.海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确;
B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C错误;
D.从框图可知:排放”出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42-的物质的量浓度排放出来的海水中浓度小,故D错误;
故选CD.
点评 本题考查了含硫烟气的处理,利用所学知识结合框图信息是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:
某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl电子式:H:Cl | B. | S原子结构示意图: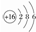 | ||
| C. | 10个中子的氧原子:${\;}_{8}^{18}$O | D. | CO2结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com