
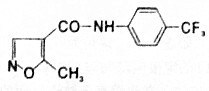
| A. | 分子式为C12H10F3N2O2 | B. | 可以发生水解反应和氧化反应 | ||
| C. | 该化合物易溶于水,难溶于酒精 | D. | 该化合物所有碳原子不可能共平面 |
分析 A.根据结构简式确定有机物分子式;
B.含有肽键,可以发生水解反应,含有碳碳双键,可以发生氧化反应;
C.属于有机物,大多数有机物难溶于水,易溶于酒精;
D.碳碳双键及连接的碳原子共面,苯环及连接的原子共面,通过旋转C-N键可以使2个平面共面.
解答 解:A.根据结构简式,可知有机物分子式为C12H9F3N2O2,故A错误;
B.含有肽键,可以发生水解反应,含有碳碳双键,可以发生氧化反应,故B正确;
C.属于有机物,大多数有机物难溶于水,易溶于酒精,该化合物可能难溶于水,易溶于酒精,故C错误;
D.碳碳双键及连接的碳原子共面,苯环及连接的原子共面,通过旋转C-N键可以使2个平面共面,所有碳原子可能共平面,故D错误.
故选:B.
点评 本题考查有机物的结构与性质,熟练掌握官能团的性质,注意根据甲烷的四面体结构、乙烯与苯的平面结构、乙炔的直线形等进行共面及共线判断.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

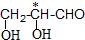 标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.
标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.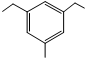 结构.有4种;写出其中一种的结构简式
结构.有4种;写出其中一种的结构简式 任意一种.
任意一种.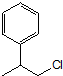 为原料合成
为原料合成 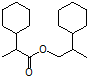 ,写出其合成路线(指明所用试剂和反应条件).
,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
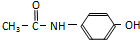 )是常用的消炎解热镇痛药.其合成路线如下:
)是常用的消炎解热镇痛药.其合成路线如下:
 →
→ 的反应类型为还原反应.
的反应类型为还原反应.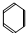 →
→ 反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯.
反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯. 与
与 的性质相似,写出一定条件下
的性质相似,写出一定条件下 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式 .
.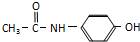 的同分异构体有3种.
的同分异构体有3种. )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛既具有氧化性也具有还原性 | |
| B. | 煤的气化和干馏原理相同 | |
| C. | 动物油加入稀硫酸生产肥皂 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 葡萄糖可用于补钙药物的合成 | |
| C. | 天然药物无任何毒副作用,可长期服用 | |
| D. | 超导陶瓷、高温结构陶瓷和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com