
氢溴酸、硫酸钡是用途广泛的工业产品。实验室利用SO2、Br2模拟工业上精制氢溴酸同时得副产品硫酸钡,有关流程如下:

(1)实验室制Br2的反应原理为2NaBr+3H2SO4(浓)+MnO2 2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。
2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。

(2)试剂a为 ,使用冰水的目的是 。
(3)加入Na2SO3的目的是除去 ,所加Na2SO3的量的多少是否会影响氢溴酸的产量? (填“影响”或“不影响”)。
(4)为得到纯净的BaSO4晶体,洗涤沉淀的具体操作为:
。
(5)工业上氢溴酸常显淡黄色,可能的原因是:①含有杂质Fe3+②含有杂质Br2③含有杂质Fe3+、Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是 (填字母)。 a.KMnO4 b.CCl4 c.NaOH d.KSCN
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A.Na+、SO32-、I- B.Na+、Br-、CO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下, 2.8g N2与C2H4的混合气体所含电子数为1.4 NA
B.标准状况下,1.12 L NO与1.12LO2的混合物中含有的原子数为0.2NA
C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA
D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反
应,生成另一种气体A。气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与
碳化钙的物质的量之比是
A.2∶1 B.1∶2 C.4∶1 D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.HIO与HCN均为含有极性键的直线形极性分子
B.SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物
C.Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生
D.明矾与离子交换树脂均能将海水进行淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是
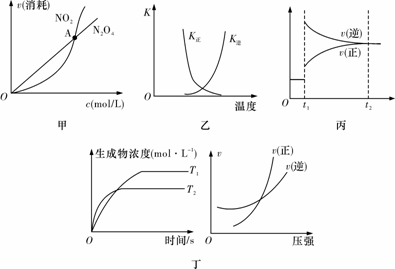
A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应2A(g)+B(g)2C(g) ΔH>0,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应2X(g)+Y(g)Z(s)+3W(g) ΔH<0在t1时刻增大压强
D.图丁表示反应aA(g)+bB(g)cC(g)+dD(g):a+b>c+d;T1<T2;ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组先向试管中加入3ml蒸馏水,滴人酚酞试液,再向试管中倒入1ml煤油,然后从试剂瓶中取出一块金属钠,用小刀切一小块放入试管中,可观察到钠首先沉到煤油底部,一接触水即产生大量气泡,钠块变成球状向上浮,同时水层变红色,一会儿之后,钠又慢慢沉降到两种液体的交界处, 又立即产生大量气泡,使钠上浮,如此反复,
 直至钠块消失.根据上述描述回答下列问题:
直至钠块消失.根据上述描述回答下列问题:
⑴本文中说明的钠的物理性质主要有:
①_____________________________________________
②_____________________________________________
③______________________________________________;
(2) 0.23g钠投入20ml水中完全反应放出气体标况下的体积是
mL,所得溶液的质量分数是 %(保留两位小数),所得溶液物质的量浓度是 mol·L-1(水的密度是1g/cm3,不计溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com