
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226kJ/mol
O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
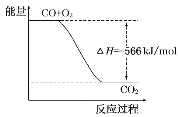
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH=-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】C
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为kJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B.图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.根据Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)△H=-226kJ/mol可知,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452kJ/mol,故C正确;
O2(g)△H=-226kJ/mol可知,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452kJ/mol,故C正确;
D.已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①到:2Na2O2(s)+2CO(g)=2Na2CO3(s) △H=-1018kJ/mol,即:Na2O2(s)+CO(g)=Na2CO3(s) △H=-509kJ/mol,则CO(g)与Na2O2(s)反应放出509kJ热量时消耗1molCO,转移了2mol电子,电子转移数为2×6.02×l023,故D错误;
O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①到:2Na2O2(s)+2CO(g)=2Na2CO3(s) △H=-1018kJ/mol,即:Na2O2(s)+CO(g)=Na2CO3(s) △H=-509kJ/mol,则CO(g)与Na2O2(s)反应放出509kJ热量时消耗1molCO,转移了2mol电子,电子转移数为2×6.02×l023,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )
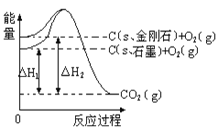
A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:
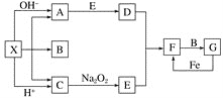
(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为高效净水剂,紫色固体,易溶于水,微溶于KOH溶液;具有强氧化性,在酸性溶液中完全、快速产生O2,在碱性溶液中较稳定。某实验小组制备高铁酸钾并探究其性质。
(1)制备K2FeO4(夹持装置略)
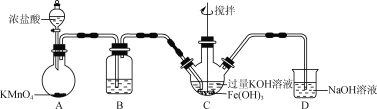
①装置B中所用试剂为____。
②C中得到紫色固体和溶液,C中发生的主要反应为________(用化学方程式表示)。
(2) 探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下![]() 与
与![]() 氧化性的强弱关系,请说明理由:____。
氧化性的强弱关系,请说明理由:____。
②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是____,___(用离子方程式表示),重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,___。[实验中必须使用的试剂:盐酸、KOH溶液、淀粉碘化钾试纸]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出H2O2电子式___;上述反应的热化学方程式______。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是____kJ。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________;基态D原子共有__________种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______(填化学式),此配离子中的两种配体的不同之处为_____________(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________;写出与BC-互为等电子体的分子和离子各一种________、_________(填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________,晶体的密度为_____ g·cm-3。
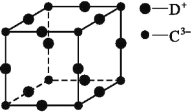
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com