
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
【答案】Cu+H2SO4+H2O2=CuSO4+2H2O 2Fe3++Cu=2Fe2++Cu2+ 防止Fe3+水解 0.1250
【解析】
(1)实验室使用稀硫酸和H2O2溶解铜片,反应中Cu被氧化为Cu2+,据此写出反应的离子方程式;
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,即Fe3+将Cu氧化为Cu2+,自身被还原为Fe2+,FeCl3溶液中Fe3+发生水解使溶液呈酸性,需保持溶液为酸性抑制Fe3+水解;
(3)根据滴定过程中发生的反应方程式计算。
(1)实验室使用稀硫酸和H2O2溶解铜片,反应中Cu被氧化为Cu2+,则发生反应的离子方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,即Fe3+将Cu氧化为Cu2+,自身被还原为Fe2+,所以过程中发生的反应为:Cu+2Fe3+=Cu2++2Fe2+;FeCl3溶液中Fe3+发生水解使溶液呈酸性,需保持溶液为酸性以抑制Fe3+水解;
(3)取20.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,发生反应:I3-+2S2O32-=S4O62-+3I-,则消耗n(I3-)=![]() ×0.1000mol/L×25.00×10-3L=1.25×10-3mol,根据I元素守恒,则20.00mL溶液中c(Cu2+)=
×0.1000mol/L×25.00×10-3L=1.25×10-3mol,根据I元素守恒,则20.00mL溶液中c(Cu2+)=![]() mol/L=0.125mol/L。
mol/L=0.125mol/L。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)写出乙烯分子的电子式:___________。
(2)写出(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H ③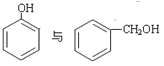 ④.
④.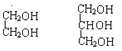 ⑤
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦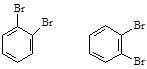
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是___,被氧化的元素是___。
(2)配平以下方程式:___K2Cr2O7+___HCl═___KCl+___CrCl3+___Cl2↑+___H2O
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3![]() 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的物质的量为___mol;标准状况下,产生NO气体的体积为___mL。
②反应后,NO3-的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其反应的离子方程式为___。
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为___,反应过程分两步,其中第2步反应的化学方程式为___。
(3)写出溶液中硫酸氢钠的电离方程式___。
(4)配制某浓度的稀硫酸,用10mL量筒量取浓硫酸的体积如图Ⅰ所示,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是___mL。

(5)要用CuSO4·5H2O晶体配制500mL0.01mol/LCuSO4溶液,应该用托盘天平称取CuSO4·5H2O___g(读到小数点后两位)
(6)图Ⅱ所示仪器的名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼美舒利是一种非甾体抗炎药,它的一种的合成路线如下:
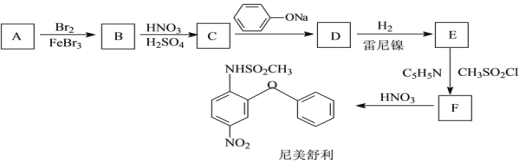
已知:![]() (易氧化)
(易氧化)
![]()
回答下列问题:
(1)B的结构简式为____,由C生成D的化学方程式为_______;
(2)E的同分异构体中能同时满足下列条件的共有___种(不含立体异构),
①含有两个苯环且两个苯环直接相连;
②能与FeCl3溶液发生显色反应;
③两个取代基不在同一苯环上。
其中核磁共振氢谱为6组峰,峰面积比为2∶2∶2∶2∶2∶1的结构简式为_____。
(3)由甲苯为原料可经三步合成2,4,6-三氨基苯甲酸,合成路线如下:

反应①的试剂和条件为______;中间体B的结构简式为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品具有耗电量低、寿命长的特点。下图是氢氧燃料电池驱动LED屏发光的装置,下列有关叙述错误的是( )
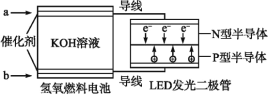
A.a处通入的气体是氢气,电极反应式为H2+2OH-2e=2H2O
B.装置中电子的流向为a极→N型半导体→P型半导体→b极
C.装置中的能量转化至少涉及三种形式的能量
D.图中![]() 表示来自氢氧燃料电池中的K+的移动方向
表示来自氢氧燃料电池中的K+的移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
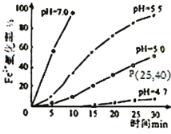
回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是___。
(6)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L-1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com